Design studie a klinické údaje
Design studie a klinické údaje
Studie STELLAR
Účinnost přípravku WINREVAIR® byla u dospělých pacientů s PAH hodnocena ve studii STELLAR, což bylo 24týdenní, globální, dvojitě zaslepené, placebem kontrolované multicentrické klinické hodnocení s paralelní skupinou.
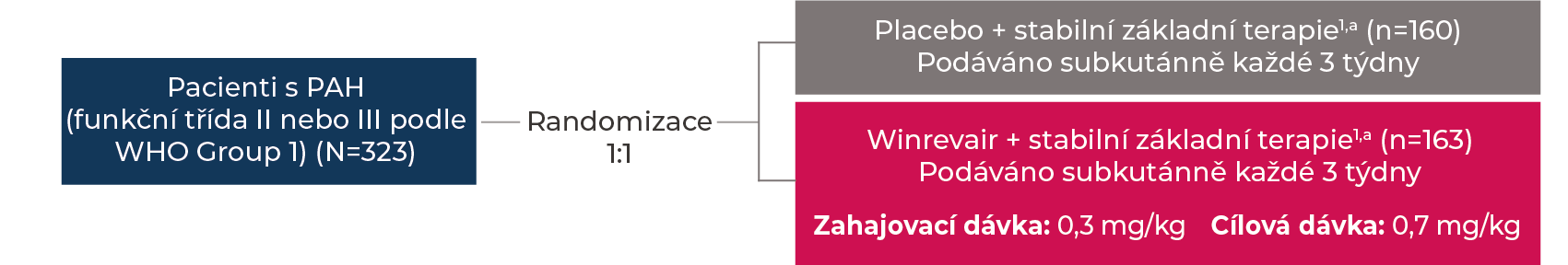
aVšichni pacienti byli po dobu ≥90 dní před zařazením na stabilních dávkách základní terapie PAH a během klinického hodnocení tuto základní léčbu nadále užívali.1
SC = subkutánní; Q3W = každé 3 týdny.
Klinické hodnocení STELLAR vyloučilo pacienty s diagnózou PAH související s HIV, PAH související s portální hypertenzí, PAH související se schistosomiázou a plicní venookluzivní nemocí.
Kritéria hodnocení účinnosti
Primární kritérium účinnosti
- Změna z výchozích hodnot vzdálenosti ušlé za 6 minut (6MWD) ve 24. týdnu
Sekundární kritéria účinnosti
- Podíl pacientů, kteří ve 24. týdnu dosáhli multikomponentního zlepšení z výchozích hodnot, definovaného jako splnění 3 z následujících kritérií:
- zlepšení 6MWD (prodloužení o ≥30 m)
- zlepšení hodnot NT-proBNP (pokles NT-proBNP o ≥30 %nebo udržení/dosažení hladiny NT-proBNP <300 pg/ml)
- zlepšení funkční třídy (FC) dle Světové zdravotnické organizace (WHO) nebo udržení FC II
- Změna z výchozích hodnot plicní cévní rezistenci ve 24. týdnu
- Změna z výchozích hodnot hladin NT-proBNP ve 24. týdnu
- Podíl pacientů, u kterých ve 24. týdnu došlo ke zlepšení FC dle WHO z výchozí hodnoty
- Doba do úmrtí nebo prvního výskytu příhody klinického zhoršení
- Příhody klinického zhoršení zahrnovaly: a) zařazení do programu transplantace plic a/nebo srdce související se zhoršením; b) potřeba zahájit záchrannou léčbu schválenou základní terapií PAH nebo potřeba zvýšit dávku infuzního prostacyklinu o 10 % nebo více; c) potřeba atriální septostomie; d) hospitalizace kvůli zhoršení PAH (≥24 hodin); e) zhoršení PAH definované tím, že se kdykoli objeví obě z následujících příhod (i když začnou v různých časech) v porovnání s jejich výchozími hodnotami: zhoršení FC dle WHO (lI na Ill, Ill na IV, lI na IV, atd.) a zkrácení 6MWD o ≥15 % potvrzené 2 testy s odstupem nejméně 4 hodin, ale ne více než 1 týden.
- Podíl pacientů, kteří si ve 24. týdnu v porovnání s výchozí hodnotou udrželi nebo dosáhli nízkého skóre rizika vypočítaného pomocí francouzského kalkulátoru skóre rizika(French risk score calculator)
- Změna z výchozích hodnot Physical Impacts Domain Score of Pulmonary Arterial Hypertension-Symptoms and Impact (PAH-SYMPACT) ve 24. týdnu
- Změna z výchozích hodnot Cardiopulmonary Symptoms Domain Score of PAH-SYMPACT ve 24. týdnu
- Změna z výchozích hodnot Cognitive/Emotional Impacts Domain Score of PAH-SYMPACT ve 24. týdnu
Zvolte výchozí charakteristiky
Demografické a výchozí klinické hladiny byly mezi skupinami léčenými přípravkem WINREVAIR® a placebem podobné.

Reference:
1. Hoeper MM, Badesch DB, Ghofrani HA, et al; STELLAR Trial Investigators. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490.
Klepnutím na roletku níže se dozvíte více o primárním kritériu hodnocení účinnosti
Ve studii STELLAR, což byla 24týdenní studie u dospělých pacientů s PAH na stabilní základní léčbě1:
přípravek WINREVAIR® významně zvyšoval námahovou kapacitu měřenou zlepšením vzdálenosti ušlé za 6 minut (6MWD) z výchozích hodnot
PRIMÁRNÍ KRITÉRIUM HODNOCENÍ
Na placebo upravený medián prodloužení 6MWD ve 24. týdnu

aHodgesův-Lehmannův lokační posun od odhadu na základě placeba (medián na placebo upravené změny z výchozích hodnot ve 24. týdnu).
Změně z výchozích hodnot 6MWD ve 24. týdnu u subjektů, které zemřely, byla přiřazena hodnota -2000 metrů, aby se dosáhlo nejhoršího stupně. Změna z výchozích hodnot 6MWD ve 24. týdnu u subjektů, u nichž kvůli nefatální příhodě klinického zhoršení údaje chyběly, byla započítána jako -1000 metrů, aby se dosáhlo druhého nejhoršího stupně.
Na placebo upravená změna z výchozích hodnot 6MWD (metry) ve 24. týdnu u podskupin
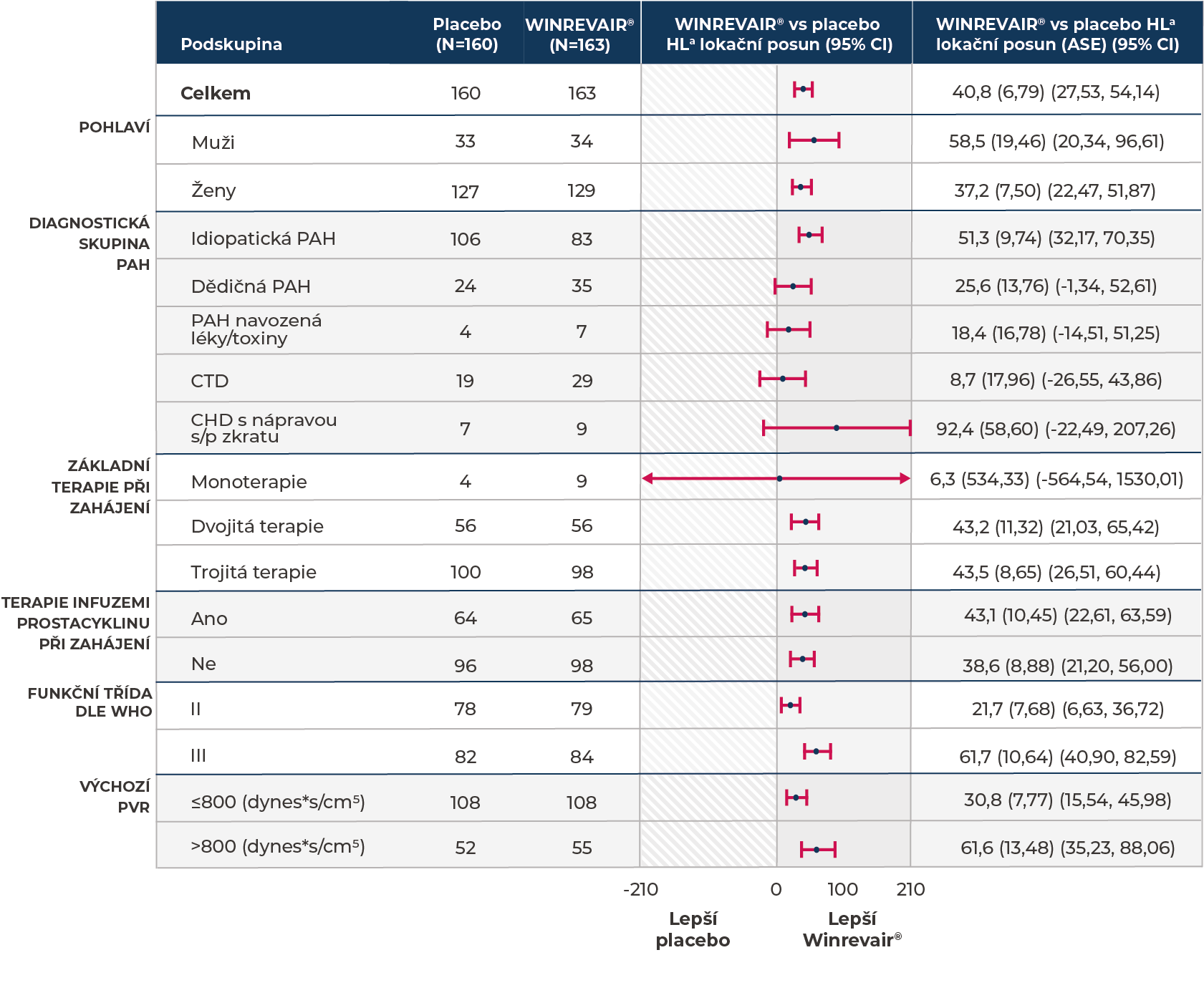
aHodgesův-Lehmannův lokační posun od odhadu na základě placeba (medián na placebo upravené změny z výchozích hodnot ve 24. týdnu).
Změně z výchozích hodnot 6MWD ve 24. týdnu u subjektů, které zemřely, byla přiřazena hodnota -2000 metrů, aby se dosáhlo nejhoršího stupně. Změna z výchozích hodnot 6MWD ve 24. týdnu u subjektů, u nichž kvůli nefatální příhodě klinického zhoršení údaje chyběly, byla započítána jako -1000 metrů, aby se dosáhlo druhého nejhoršího stupně.
ASE = asymptotická standardní odchylka; CHD = vrozené onemocnění srdce; HL = Hodgesův-Lehmannův; s/p = ze systémového na plicní.
Primární kritérium hodnocení ve studii STELLAR: změna 6MWD z výchozích hodnot ve 24. týdnu1
Zatímco v klinickém hodnocení STELLAR byl primárním kritériem hodnocení na placebo upravený medián změny prodloužení 6MWD ve 24. týdnu, tento graf ukazuje pozorovanou průměrnou změnu 6MWD (v metrech, 95% Cl). Ušlá vzdálenost byla zaznamenávána v průběhu prvních 24 týdnů klinického hodnocení při předem specifikovaných návštěvách v rámci klinického hodnocení (0., 3., 12. a 24. týden).a
Intervaly spolehlivosti (CI) nebyly upraveny na multiplicitu a nelze je využívat k vyvozování definitivních účinků léčby.
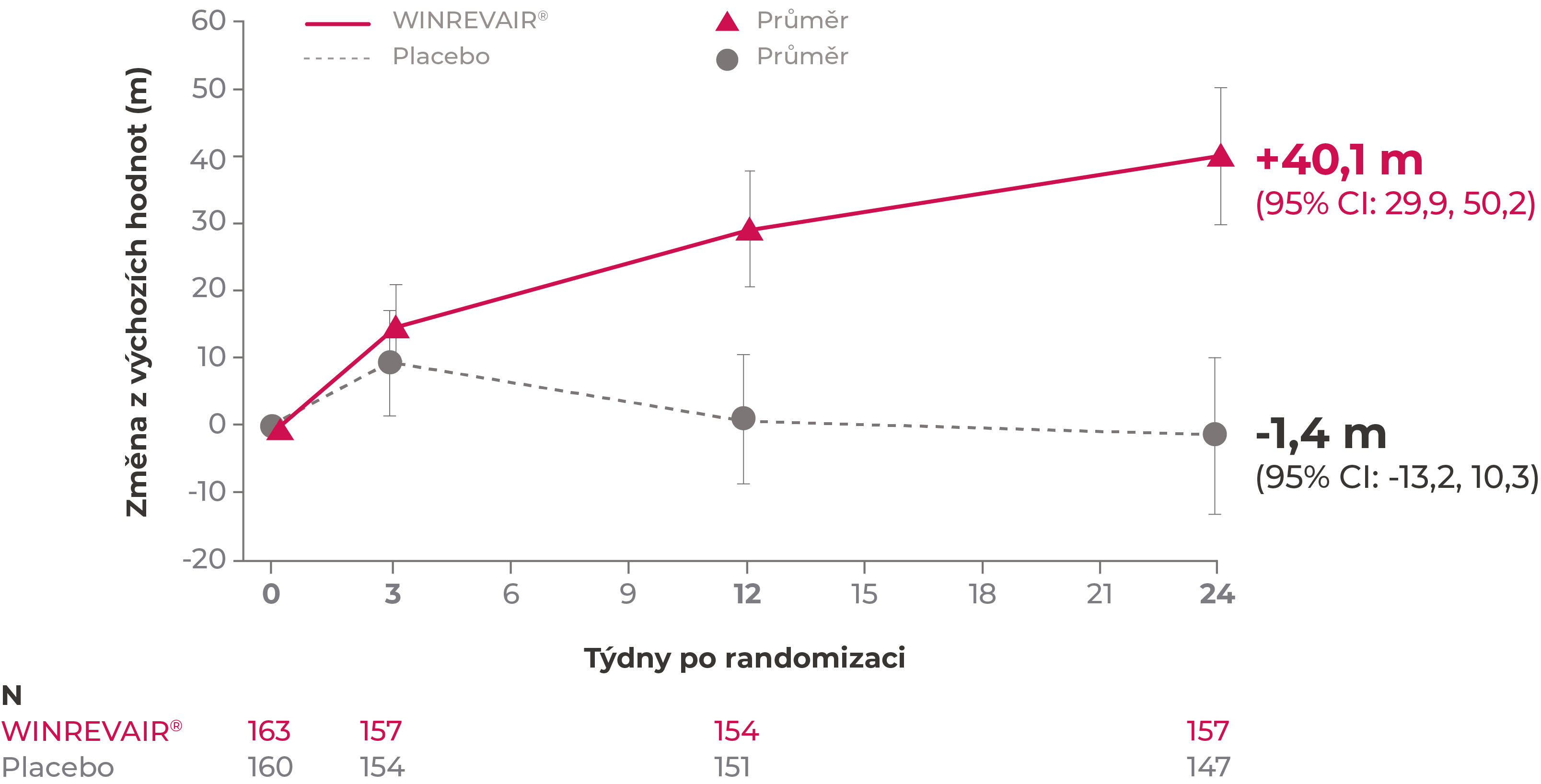
aUvedené údaje se týkají pacientů s dostupnými údaji (pozorovanými) v čase.
Reference:
1. Hoeper MM, Badesch DB, Ghofrani HA, et al; STELLAR Trial Investigators. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490.
Klepnutím na odkaz níže se dozvíte více o každém sekundárním kritériu hodnocení účinnosti
Ve studii STELLAR, což byla 24týdenní studie u dospělých pacientů s PAH na stabilní základní léčbě1:
došlo u pacientů užívajících přípravek WINREVAIR® ke zlepšení ve více sledovaných parametrech vs placebo
Parametry byly definovány jako jako podíl pacientů, kteří ve 24. týdnu v porovnání s výchozím stavem splňovali všechna 3 z následujících kritérií:
- zlepšení 6MWD (prodloužení o ≥30 m)
- zlepšení NT-proBNP (pokles o ≥30 % nebo uchování/dosažení hladiny NT-proBNP <300 pg/ml)
- zlepšení FC dle WHO nebo uchování FC II dle WHO
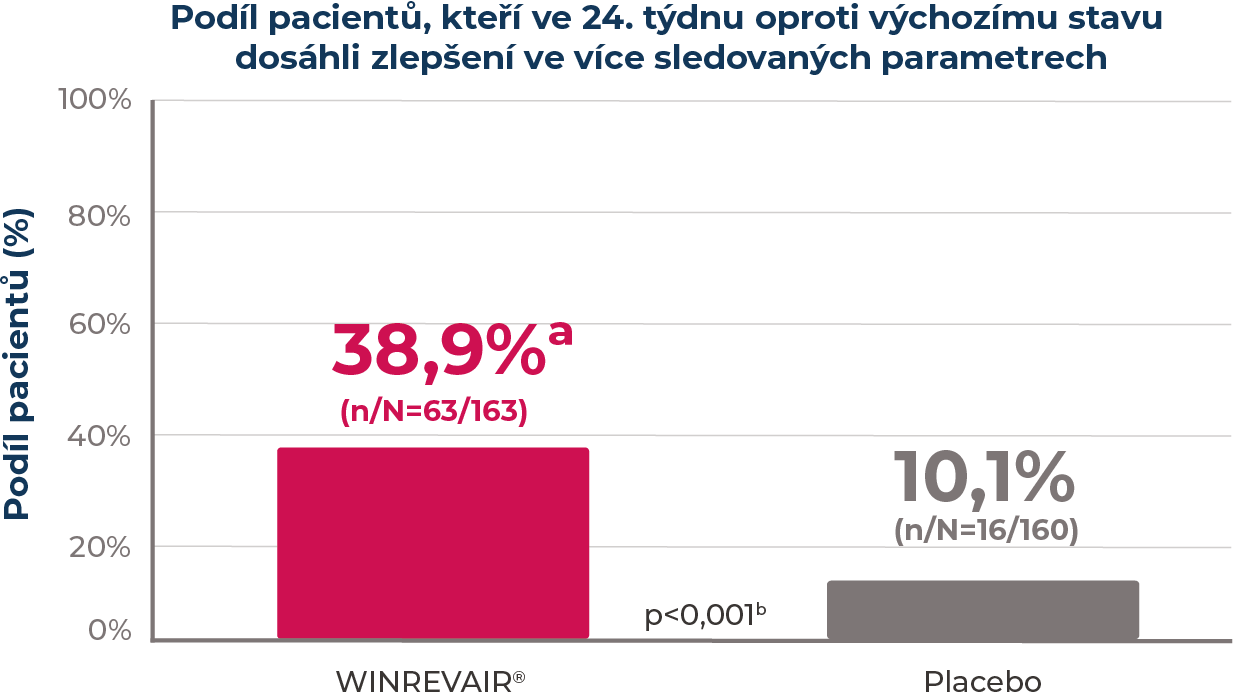
aVýsledek chybějící ve 24. týdnu nikoli kvůli COVID-19 se považoval za nonrespondéra. Subjekty, u nichž vyšetření chybělo kvůli COVID-19 byly z denominátoru vyřazeny.
bSrovnání s placebem využívá Cochranovy-Mantelovy-Haenszelovy metody stratifikované podle randomizačních faktorů.
Reference:
1. Hoeper MM, Badesch DB, Ghofrani HA, et al; STELLAR Trial Investigators. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490.
Ve studii STELLAR, 24týdenní studie u dospělých pacientů s PAH na stabilní základní léčbě1
WINREVAIR® prokázala v porovnání s placebem významné zlepšení plicní cévní rezistence (PVR) a hladiny NT-proBNP

aHodgesův-Lehmannův odhad lokačního posunu od placeba (medián na placebo upravené změny z výchozích hodnot ve 24. týdnu).
bZměna z výchozích hodnot u PVR ve 24. týdnu u subjektů, které zemřely, byla uvedena jako 20000, aby se získalo nejhorší hodnocení. Změna z výchozích hodnot u PVR ve 24. týdnu u subjektů, u nichž v důsledku příhody nefatálního klinického zhoršení chyběly údaje, byla započítána jako 15000, aby se získalo druhé nejhorší hodnocení.
cZměna z výchozích hodnot u NT-proBNP ve 24. týdnu u subjektů, které zemřely, byla uvedena jako 200000, aby se získalo nejhorší hodnocení. Změna z výchozích hodnot u NT-proBNP ve 24. týdnu u subjektů, u nichž v důsledku příhody nefatálního klinického zhoršení chyběly údaje, byla započítána jako 150000, aby se získalo druhé nejhorší hodnocení.
dVe skupině léčené placebem byly 3 účastníci, bez vzorků NT-proBNP v každém okamžiku. V takových případech nebyly chybějící údaje započítány.
eWilcoxonova hodnota p označuje hodnotu p z přiřazeného Wilcoxonova testu stratifikovaného dle hodnocení, kde se jako strata využily randomizační faktory.
Ve studii STELLAR, což byla 24týdenní studie u dospělých pacientů s PAH na stabilní základní léčbě1:
Analýzy předem specifikovaných podskupin vybraných etiologií PAH u pacientů užívajících přípravek WINREVAIR® vs placebo2,a
OMEZENÍ: studie STELLAR neměla sílu detekovat rozdíly v léčebném účinku u těchto podskupin, přičemž intervaly spolehlivosti (CI) nebyly upraveny na multiplicitu. Tyto podskupiny tvoří malé a nevyvážené počty pacientů ze všech léčebných větví. Výsledky těchto analýzy předem specifikovaných podskupin je nutno interpretovat opatrně.
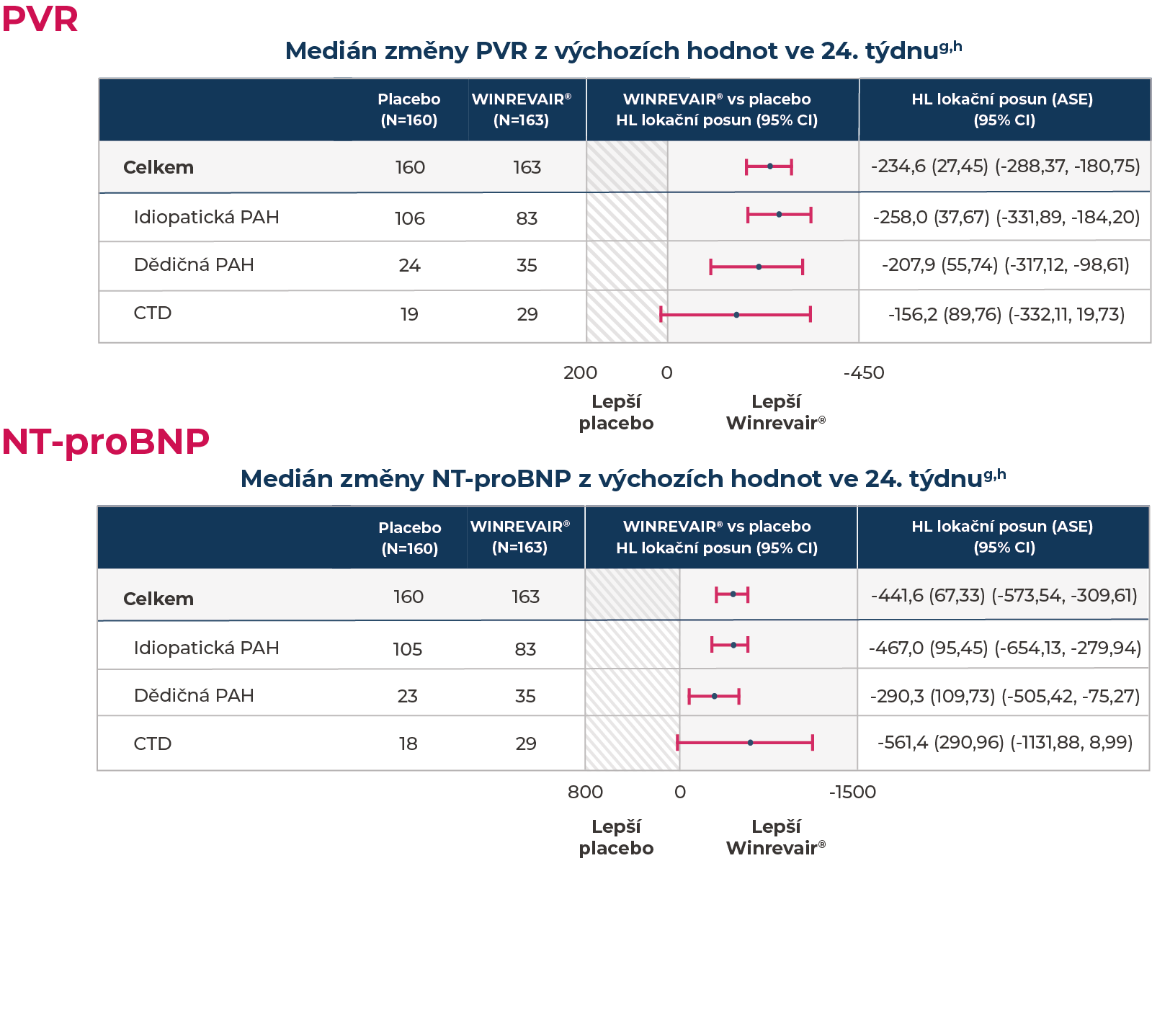
- aJako součást této analýzy podskupin byl rovněž zařazen medián změny PVR a NT-proBNP z výchozích hodnot ve 24. týdnu ohledně léky/toxinem navozené PAH (WINREVAIR®, n/N = 7/163; placebo, n/N = 4/160) a ohledně vrozeného onemocnění srdce s nápravou s/p zkratu (WINREVAIR®, n/N = 9/163; placebo, n/N = 7/160).
bGraf u každé podskupiny ukazuje odhadované body Hodgesova-Lehmanova lokačního posunu (95% CI) u mediánu na placebo upravené změny z výchozích hodnot ve 24. týdnu.
cPacientům, u nichž kvůli úmrtí nebo nefatální příhodě klinického zhoršení chyběly hodnoty, byly přiřazena nejhorší, respektive druhá nejhorší skóre. Hodnoty chybějící z jiných důvodů než úmrtí nebo nefatální příhoda klinického zhoršení byly započítány pomocí plně podmíněného specifikačního regresního modelu, který předpokládal, že údaje chyběly náhodně.
Střední hodnota změny mPAP v 24. týdnu oproti výchozí hodnotě2,4
OMEZENÍ: tato analýza byla průzkumné povahy a nebyla upravena na multiplicitu. Nelze ji použít ke stanovení definitivních příčinných vztahů nebo léčebných účinků. Výsledky je nutno interpretovat opatrně.

- aOdvozeno z modelu analýzy konvariance (ANCOVA) s léčbou, základní terapií jako stratifikačním faktorem randomizace (monoterapie nebo terapie dvojkombinací nebo terapie trojkombinací) a výchozí FC dle WHO (II vs III) jako fixními faktory a hodnoceným výchozím parametrem jako kovariátou.
- PVR =(mPAP – plicní arteriální tlak v zaklínění)/srdeční výdej.3
- RHC = katetrizace pravého srdce.
Reference:
1. Hoeper MM, Badesch DB, Ghofrani HA, et al. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490. 2. Hoeper MM, Badesch DB, Ghofrani HA, et al; STELLAR Trial Investigators. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16)(suppl):S1-S69. 3. Simmoneau G, Montani D, Celermajer DS, et al. Haemodynamic definitions and updated clinical classification of pulmonary hypertension. Eur Respir J. 2019;53(1):1801913. 4. Humbert M, Kovacs G, Hoeper MM, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J. 2022;43(38):3618-3731.
Ve studii STELLAR, což byla 24týdenní studie u dospělých pacientů s PAH na stabilní základní léčbě1:
u významně více pacientů užívajících přípravek WINREVAIR® došlo v porovnání s placebem ke zlepšení funkční třídy (FC) dle Světové zdravotnické organizace (WHO)
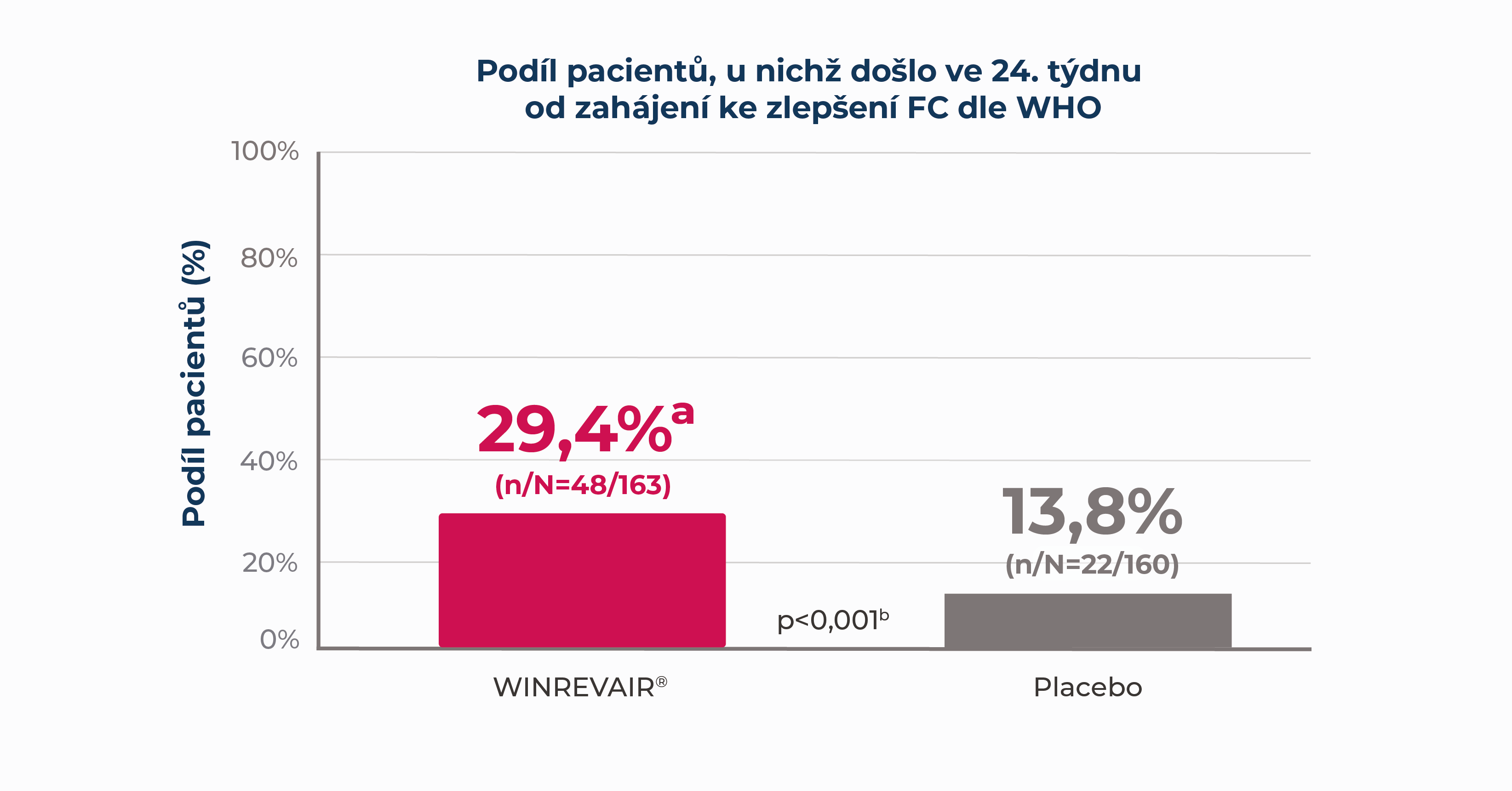
aVýsledek chybějící ve 24. týdnu nikoli kvůli COVID-19 se považoval za nonrespondéra. Subjekty, u nichž vyšetření chybělo kvůli COVID-19 byly z denominátoru vyřazeny.
bSrovnání s placebem využívá Cochranovy-Mantelovy-Haenszelovy metody stratifikované podle randomizačních faktorů.
Reference:
1. Hoeper MM, Badesch DB, Ghofrani HA, et al. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490.
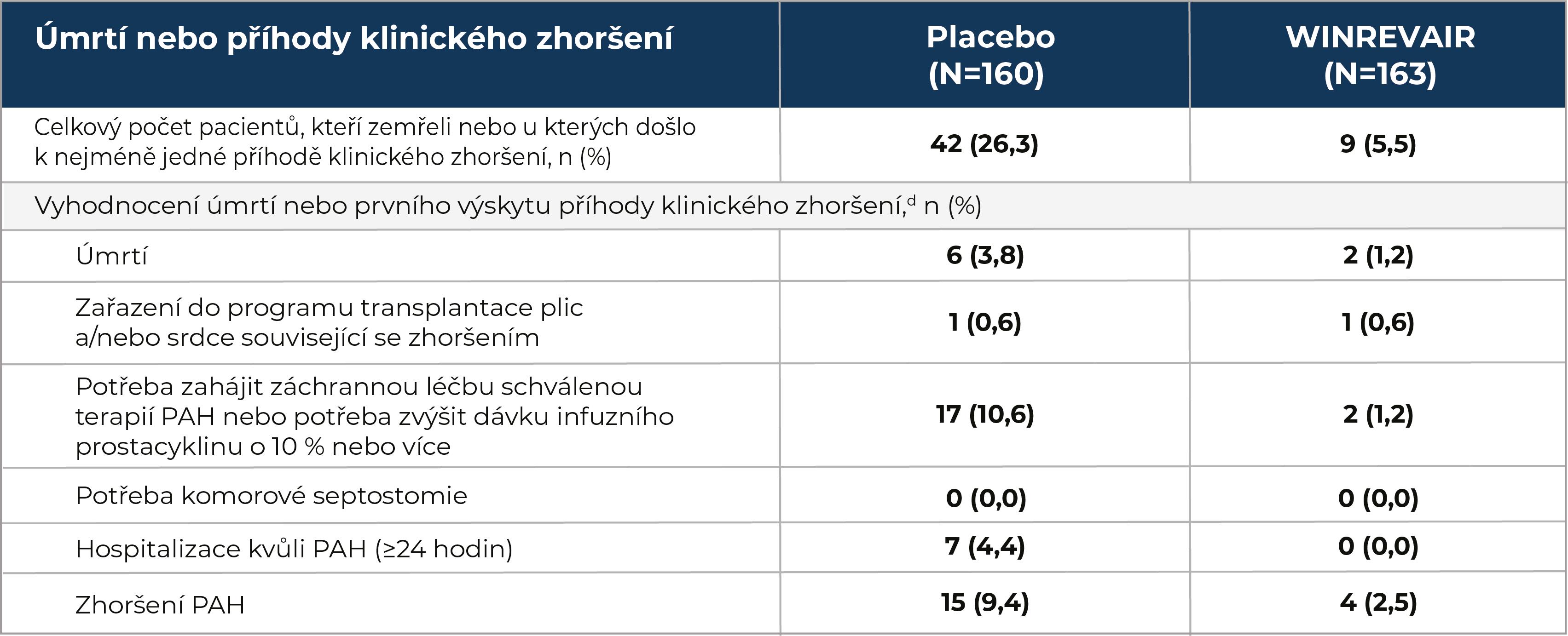
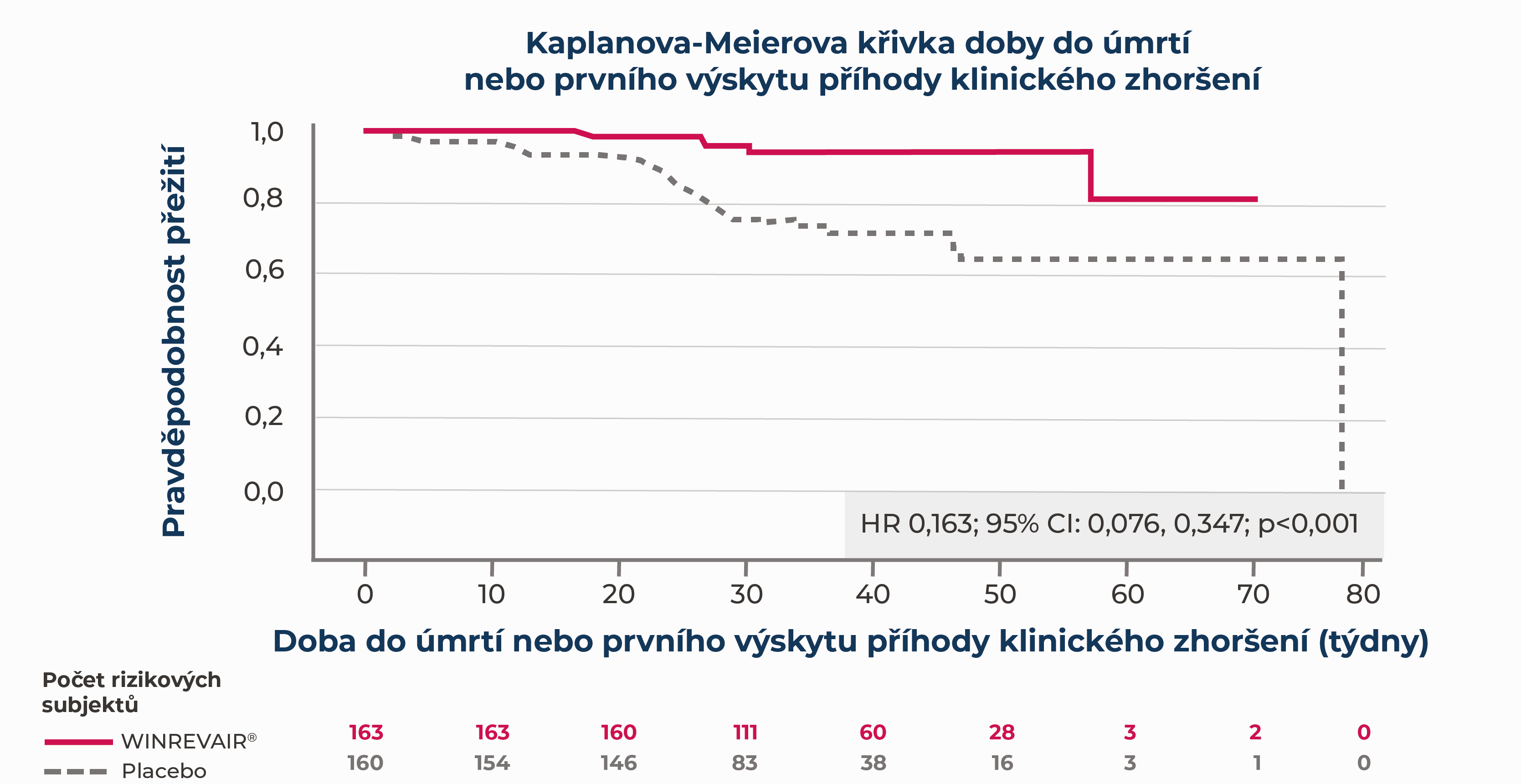
Ve studii STELLA R, což byla 24týdenní studie u dospělých pacientů s PAH na stabilní základní léčbě1:
přípravek WINREVAIR® ve srovnání s placebem významně snižoval výskyt úmrtí nebo příhod klinického zhoršení

U devíti ze 163 (5,5 %) pacientů ve skupině léčené přípravkem WINREVAIR® došlo k úmrtí nebo příhodě klinického zhoršení v porovnání se 42 ze 160 (26,3 %) pacientů ve skupině léčené placebem.
Příhody klinického zhoršení a úmrtí byly zaznamenávány, dokud poslední pacient nedokončil návštěvu ve 24. týdnu (údaje do data uzávěrky údajů). Medián trvání expozice byl 33,6 týdne.
aDoba do úmrtí nebo prvního výskytu kterékoli z následujících příhod klinického zhoršení: a) zařazení do programu transplantace plic a/nebo srdce související se zhoršením; b) potřeba zahájit záchrannou léčbu schválenou základní terapií PAH nebo potřeba zvýšit dávku infuzního prostacyklinu o 10 % nebo více; c) potřeba komorové septostomie; d) hospitalizace kvůli zhoršení PAH (≥24 hodin); e) zhoršení PAH definované tím, že se kdykoli objeví obě z následujících příhod (i když začnou v různých časech) v porovnání s jejich výchozími hodnotami: zhoršení FC dle WHO (lI na Ill, Ill na IV, lI na IV, atd.) a zkrácení 6MWD o ≥15 % potvrzené 2 testy s odstupem nejméně 4 hodin, ale ne více než 1 týden.
bSrovnání pomocí log.rank testu, kde placebo bylo stratifikováno podle randomizačních faktorů.
cPoměr rizik (HR) (WINREVAIR®/placebo) byl odvozen z Coxova proporčního modelu rizik, kde léčebná skupina jako kovariáta byla stratifikována podle randomizačních faktorů.
dSubjekt mohl mít zaznamenáno více než jedno vyšetření ohledně první příhody klinického zhoršení. Vyskytly se 3 subjekty ve skupině léčené placebem a 0 subjektů ve skupině léčené přípravkem WINREVAIR®, které ohledně první příhody klinického zhoršení měly více než jedno vyšetření.
eZhoršení terapie PAH je definováno tak, že se kdykoli objeví obě z následujících příhod, i když začnou v různých časech, v porovnání s jejich výchozími hodnotami: (a) zhoršení FC dle WHO (lI na Ill, Ill na IV, lI na IV, atd.) a (b) zkrácení 6MWD o ≥15 % (potvrzeno 2 testy s odstupem nejméně 4 hodin, ale ne více než 1 týden).
Reference:
1. Hoeper MM, Badesch DB, Ghofrani HA, et al. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490.
Ve studii STELLA R, což byla 24týdenní studie u dospělých pacientů s PAH na stabilní základní léčbě1:
významně více pacientů užívajících přípravek WINREVAIR® v porovnání s placebem si udrželo nebo dosáhlo nízké French risk score
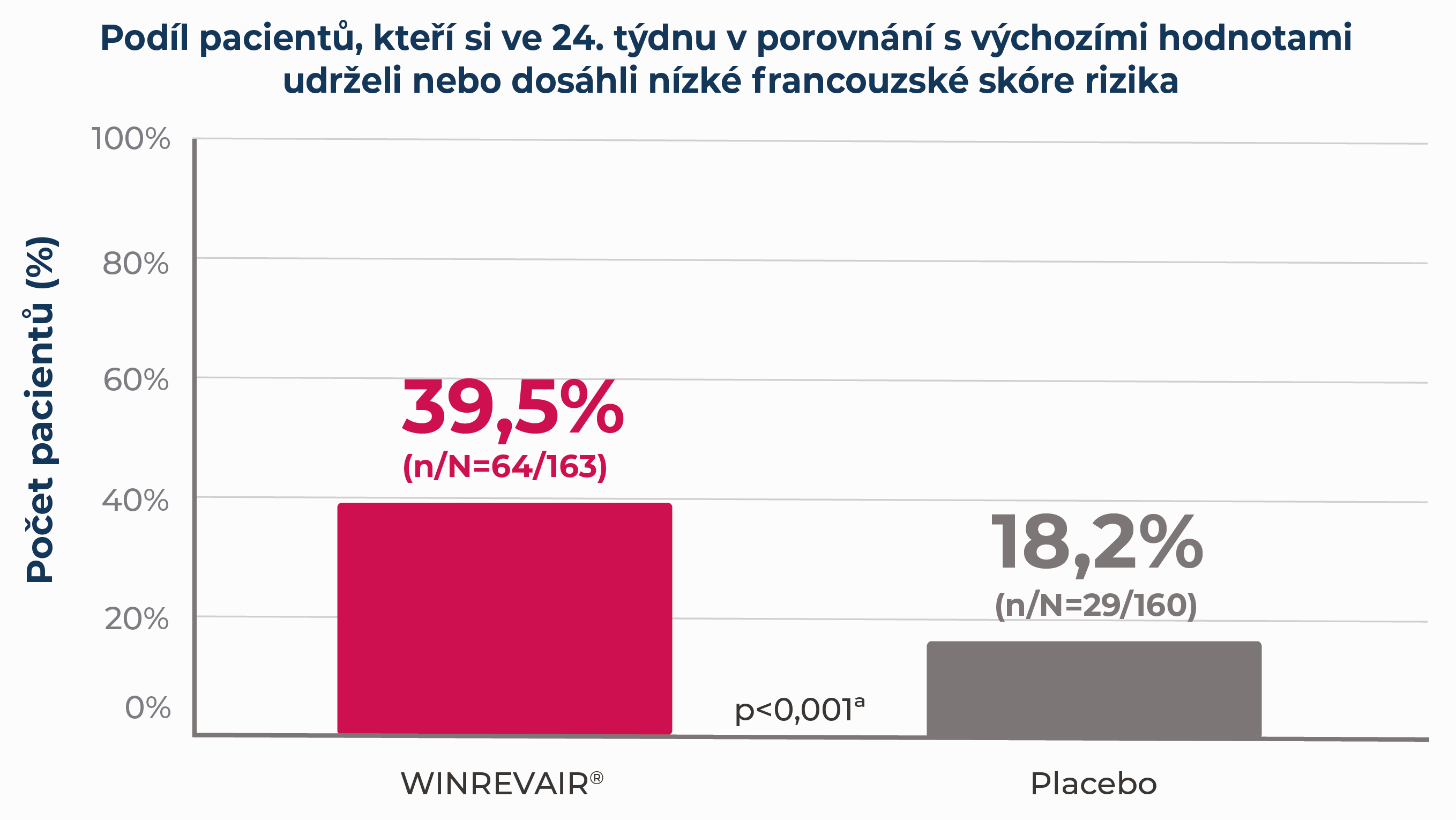
aComparison with placebo uses Cochran-Mantel-Haenszel method stratified by randomization factors.
Reference:
1. Hoeper MM, Badesch DB, Ghofrani HA, et al. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490.
Ve studii STELLAR, což byla 24týdenní studie u dospělých pacientů s PAH na stabilní základní léčbě1:
přípravek WINREVAIR® v porovnání s placebem významně zlepšoval pacientova PAH-SYMPACT® Physical lmpacts and Cardiopulmonary Symptoms Domain Scores
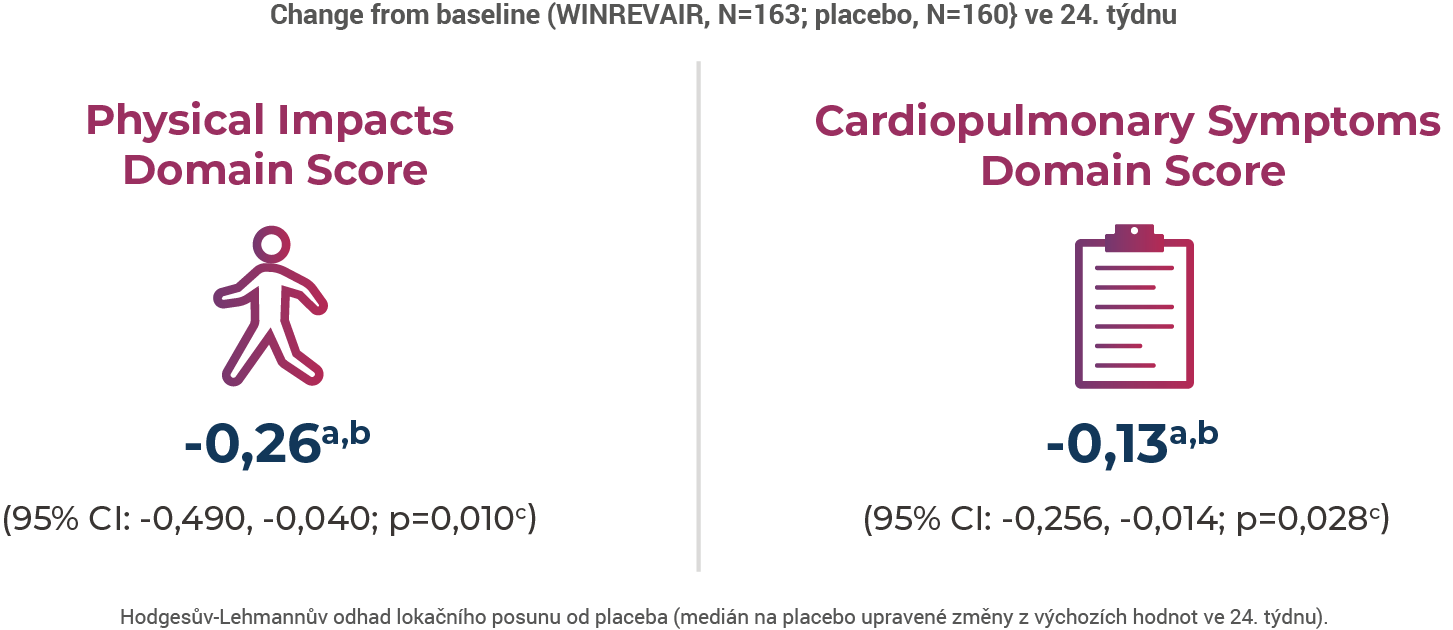
Změna z výchozích hodnot Cognitive/Emotional lmpacts Domain Score of Pulmonary Arterial Hypertension
Symptoms and lmpact (PAH-SYMPACT®) přípravku WINREVAIR® vs placebo ve 24. týdnu nebyla statisticky významná (-0,16a,b; 95% Cl: -0,399, 0,084; p=0,156c).
PAH-SYMPACT® je pro danou nemoc specifický nástroj měření výsledků založený na hlášení pacientem. Doménová skóre se pohybují od 0 do 4, kdy vyšší skóre ukazujíc větší závažnost příznaků1
aHodgesův-Lehmannův odhad lokačního posunu od placeba (medián na placebo upravené změny z výchozích hodnot ve 24. týdnu)..
bZměně z výchozích hodnot skóre SYMPACT ve 24. týdnu u subjektů, které zemřely, byla přidělena hodnota 200, aby se dosáhlo nejhoršího hodnocení. Změna z výchozích hodnot skóre SYMPACT ve 24. týdnu u subjektů, u nichž údaje chyběly kvůli nefatální příhodě klinického zhoršení, byla započítána v hodnotě 150, aby se získalo druhé nejhorší hodnocení.
cWilcoxonova hodnota p označuje hodnotu p ze sladěného rank-stratifikovaného Wilcoxonova testu s randomizačními faktory použitými jako strata.
Reference: 1. Hoeper MM, Badesch DB, Ghofrani HA, et al; STELLAR Trial Investigators. Phase 3 trial of sotatercept for treatment of pulmonary arterial hypertension. N Engl J Med. 2023;388(16):1478-1490.
WINREVAIR® přinesl zlepšení u 8 z 9 sekundárních kritérií hodnocení
