Bezpečnostní profil
Bezpečnostní profil
Následující údaje odrážejí expozici přípravku WINREVAIR® v pivotním klinickém hodnocení STELLAR
- Po dokončení primární 24týdenní léčebné fáze pacienti pokračovali dlouhodobým, dvojitě zaslepeným léčebným obdobím, kdy stávající léčba byla zachována, dokud všichni pacienti nedokončili primární léčebné období.
- Medián trvání léčby byl u skupiny léčené placebem a u skupiny léčené přípravkem WINREVAIR® podobný (229,5 dne vs 252,0 dne, v uvedeném pořadí).
Nežádoucí účinky, které se objevily ve studii STELLAR k okamžiku, kdy primární 24týdenní období studie dokončili všichni pacienti, jsou shrnuty níže.
Nežádoucí účinky u pacientů léčených přípravkem WINREVAIR® (DBPC + LTDB)a:
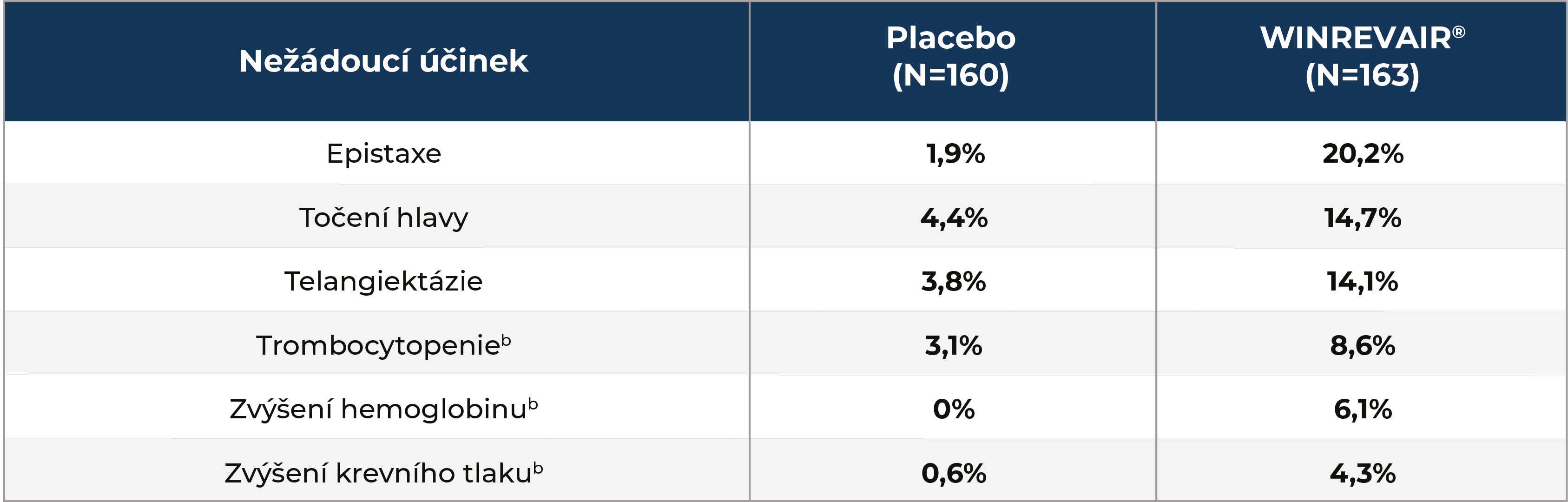
aDouble-blind placebo-controlled period + long-term double-blind period.
bKompositní sledované parametry.
Zvýšený hemoglobin
Většina příhod zvýšeného hemoglobinu (zvýšený Hgb, polycytemie) byla nezávažných, mírných a reverzibilních, přičemž příhody nebyly spojeny s vysazením léčby.
- Středně závažná zvýšení Hgb (>2 g/dl nad horní limit normálu ]) se objevila u 12,3 % pacientů užívajících přípravek WINREVAIR®.
- Nebyla pozorována žádná závažná zvýšení (≥4 g/dl nad).
- Zvýšení Hgb bylo možno zvládnout odložením dávky, snížením dávky nebo obojím.
Trombocytopenie
Většina příhod trombocytopenie (trombocytopenie a pokles počtu krevních destiček) byla nezávažných, mírných, reverzibilních, přičemž příhody nebyly spojeny s vysazením léčby.
- Závažné snížení počtu krevních destiček <50 000/mm3 (- <50,0 x 109/l) se objevilo u 1,8 % pacientů užívajících přípravek WINREVAIR®.
- Trombocytopenie se vyskytovala častěji u pacientů, kteří rovněž dostávali infuze prostacyklinu (10,8 % užívajících přípravek WINREVAIR® a 0 % užívajících placebo) v porovnání s pacienty, kteří infuze prostacyklinu neužívali (3,1 % pacientů užívajících přípravek WINREVAIR® a 3,1 % pacientů užívajících placebo).
Telangiektasie
Případy telangiektasie byly nezávažné a jejich závažnost se v čase nezvyšovala.
- U všech pacientů vystavených přípravku WINREVAIR® byl medián doby do nástupu 47,1 týdne.
- Vysazení léčby kvůli telangiektasii nastalo u 1 % ve skupině léčené přípravkem WINREVAIR a u 0 % ve skupině léčené placebem.
- S telangiektasií nebyly spojeny žádné epizody závažného krvácení.
Zvýšený krevní tlak
Příhody zvýšeného krevního tlaku (hypertenze, zvýšený diastolický krevní tlak, zvýšený krevní tlak) byly nezávažné, přičemž žádné těžké příhody nebyly hlášeny.
- U pacientů užívajících přípravek WINREVAIR® se ve 24. týdnu průměrný systolický krevní tlak zvýšil z výchozích hodnot o 2,2 mmHg a diastolický krevní tlak se zvýšil o 4,9 rnmHg.
- U pacientů užívajících placebo byla změna z výchozích hodnot průměrného systolického krevního tlaku -1,6 mmHg a -0,6 u diastolického krevního tlaku.
Vysazení léčby
Celková incidence vysazení léčby kvůli nežádoucímu účinku byla 4 % ve skupině léčené přípravkem WINREVAIR® a 7 % ve skupině léčené placebem.
Ve skupině léčené přípravkem WINREVAIR® nedošlo k žádným specifickým nežádoucím účinům vedoucím k vysazení léčby, které by se vyskytly s četností vyšší než 1 % a častěji.
Dlouhodobé bezpečnostní údaje
Dlouhodobé údaje o bezpečnosti byly získány v rámci klinického hodnocení fáze 2 (PULSAR), které zahrnovalo 24týdenní, dvojitě zaslepené, placebem kontrolované léčebné období následované 30měsíčním, otevřeným prodlouženým obdobím (n =104). Většina těchto pacientů poté pokračovala v dlouhodobé pozorovací studii.
- Průměrné trvání expozice přípravku WINREVAIR® ve studii PULSAR a dlouhodobé pozorovací studii bylo 151týdnů s maximální expozicí 218 týdnů.
- Bezpečností profil byl obecně podobný bezpečnostnímu profilu pozorovanému v pivotní studii STELLAR.
- Nicméně během dvojitě zaslepeného, placebem kontrolovaného léčebného období studie PULSAR nebyla pozorována telangiektasie.
- Telangiektasie byla poprvé hlášena v otevřeném prodloužení, kdy se vyskytla u 27 % pacientů při dokončení studie s mediánem doby do nástupu 106 týdnů.
