Gardasil®9 (dávkování pro osoby od 9-15 let)
Gardasil®9 je rekombinantní, adsorbovaná, 9valentní vakcína proti lidskému papilomaviru (HPV).
Gardasil®9 je indikován k aktivní imunizaci osob od 9 let věku proti následujícím HPV onemocněním:1
- premaligní léze a malignity postihující cervix, vulvu, vaginu a anus způsobené vakcinačními typy HPV
- genitální bradavice (Condyloma acuminata) způsobené specifickými typy HPV
Úhrada
Od 1. 1. 2024 je vakcína Gardasil®9 je plně hrazena z prostředků veřejného zdravotního pojištění všem dívkám a chlapcům od 11 let do 14 let včetně.
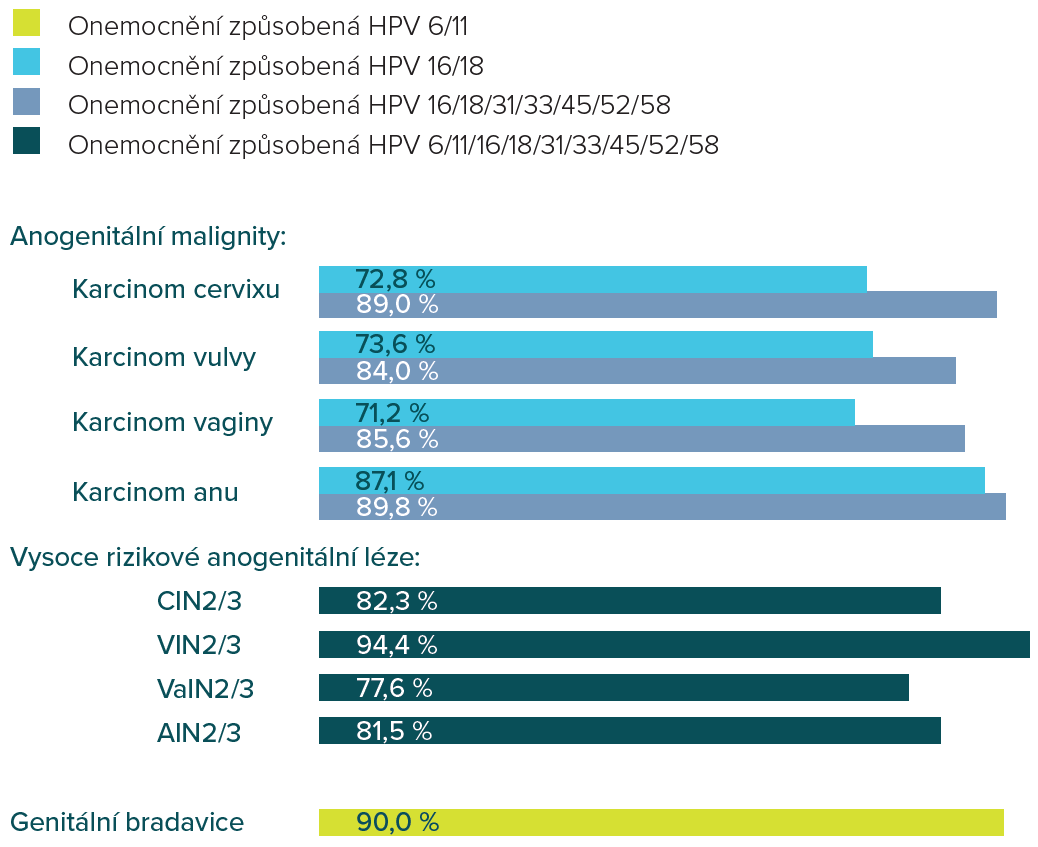
Gardasil®9 kombinuje1-3

Podíl jednotlivých typů HPV na vzniku onemocnění asociovaných s HPV 2,4
Gardasil®9 v klinických studiích poskytoval
V klinických studiích v PPE populaci (léčené podle protokolu; Per Protocol Efficacy) byla studováná dlouhodobá účinnost qHPV vakcíny proti cílovým parametrům onemocnění spojených s HPV typu 6, 11, 16 a 18. Byly podány všechny 3 dávky qHPV vakcíny. V těchto studiích nebyly pozorovány žádné případy intraepiteliálních neoplazií vysokého stupně a genitálních bradavic po dobu sledování až 10,7 roku u dívek (n = 369) a 10,6 roku u chlapců (n = 326), jimž bylo v době očkování 9 až 15 let.
V klinické studii byla měřena imunitní odpověď na Gardasil 9 v 7. měsíci jako procento jedinců, kteří byli séropozitivní na protilátky proti příslušným typům HPV obsaženým ve vakcíně 99,2 % až 100 % jedinců ve všech testovaných skupinách bylo séropozitivních na všechny sledované HPV typy 6, 11, 16, 18, 31, 33, 45,52 a 58.
V dlouhodobých prodlouženích klinických studií podle Protokolů 001 a 002 byla pozorována perzistence protilátkové odpovědi po dobu alespoň 10 let u chlapců a dívek ve věku 9 až 15 let v době očkování přípravkem Gardasil 9, v závislosti na typu HPV bylo 81 % až 98 % subjektů séropozitivních.
Bezpečnostní profil vakcíny Gardasil®9
9valentní vakcína proti HPV (Gardasil®9) a 4valentní vakcína proti HPV (Gardasil®) vykazovaly podobný bezpečnostní profil, ačkoliv výskyt reakcí v místě injekce byl numericky vyšší u osob, kterým byl aplikován Gardasil®9.5,8
Nejčastějšími nežádoucími účinky pozorovanými po aplikaci přípravku Gardasil 9 byly reakce v místě aplikace injekce (84,8 % očkovaných jedinců v průběhu 5 dnů po některé z očkovacích návštěv) a bolest hlavy (13,2 % očkovaných jedinců v průběhu 15 dnů následujících po některé z očkovacích návštěv). Tyto nežádoucí účinky byly obvykle mírné nebo středně závažné.
Z reakcí v místě vpichu se nejčastěji vyskytovaly bolest, otok, erytém, pruritus a tvorba modřin, většina z těchto reakcí přitom byla pouze mírné nebo střední intenzity.1,6
Očkovací schéma pro osoby ve věku od 9 do 15 let1
