Vaxneuvance® (indikace pro děti)
Vaxneuvance® je 15valentní pneumokoková konjugovaná vakcína dostupná pro Vaše pediatrické pacienty ve věku od 6 týdnů a starší.
Vakcína Vaxneuvance® je indikována k aktivní imunizaci za účelem prevence invazivního onemocnění, pneumonie a akutního zánětu středního ucha způsobených bakterií Streptococcus pneumoniae u kojenců, dětí a dospívajících ve věku od 6 týdnů do < 18 let.1
Vakcína Vaxneuvance® je taktéž indikována k aktivní imunizaci za účelem prevence invazivního onemocnění a pneumonie způsobené bakterií Streptococcus pneumoniae u jedinců ve věku 18 let a starších.1
Vaxneuvance® přináší kombinaci silné imunogenity a širokého sérotypového pokrytí ve schématu 2+1.1

Vaxneuvance® byla vyvinuta společností MSD pro ochranu kojenců a dětí před rizikem pneumokokového onemocnění:
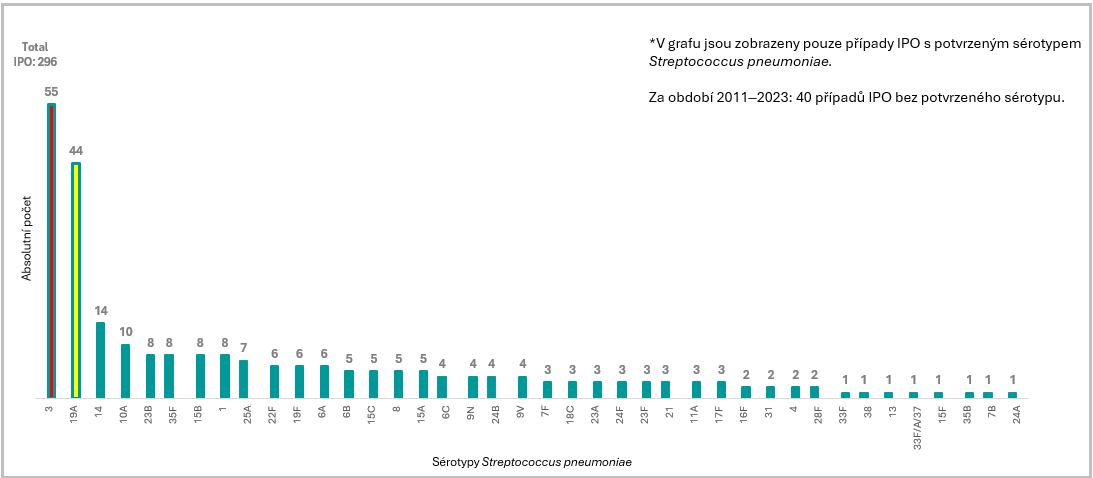
- Sérotyp 3 je dlouhodobě nejčastějším původcem IPO u dětí ve věku < 5 let v ČR2-15
PNEUMOKOKOVÉ ONEMOCNĚNÍ JE I NADÁLE VELKOU HROZBOU PRO DĚTI
Pneumokokové onemocnění je spojeno s morbiditou a mortalitou. Zahrnuje invazivní pneumokokové onemocnění, pneumokokovou pneumonii a akutní zánět středního ucha.16,*
Mezi invazivní pneumokoková onemocnění (IPO) se řadí:16
- Bakteriémie
- Sepse
- Meningitida
*Mimo jiné infekce16
Invazivní pneumokové onemocnění je spojeno se závažnými komplikacemi, celoživotními následky a úmrtím.17, 18, 19
Akutní zánět středního ucha

Děti ve věku ≤ 2 let podléhají velkému riziku nákazy pneumokokovým onemocněním.21
JE DŮLEŽITÉ ZAMĚŘIT SE NA PŘEDNÍ PŘÍČINY PNEUMOKOKOVÉHO ONEMOCNĚNÍ
Sérotyp 3 je dlouhodobě nejčastějším původcem IPO u dětí ve věku < 5 let v ČR.2-15
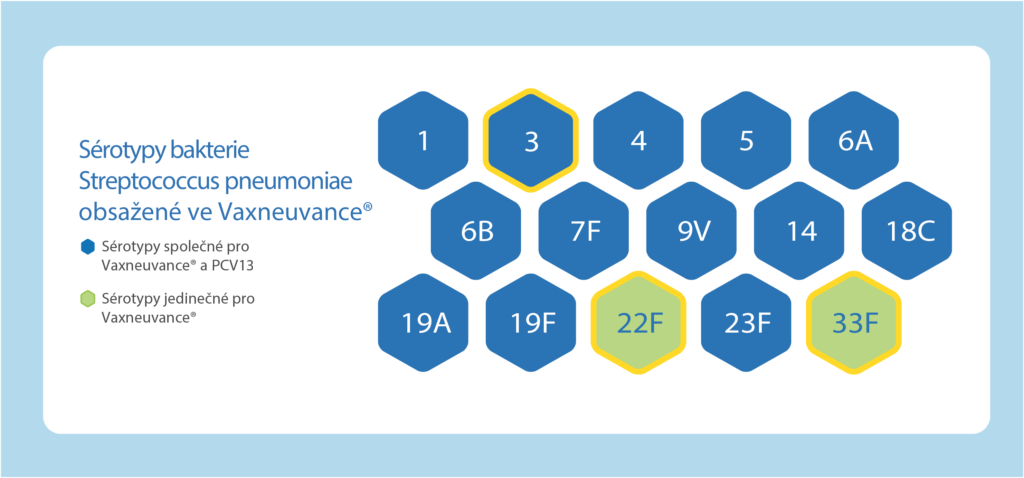
Vaxneuvance®přináší široké sérotypové pokrytí a zároveň zachovává imunogenitu pro sérotypy nacházející se v předchozích pneumokokových konjugovaných vakcínách.1
Zastoupení sérotypů IPO dle výskytu (2011–2024 kumulativně), ČR, děti pod 5 let věku2-16
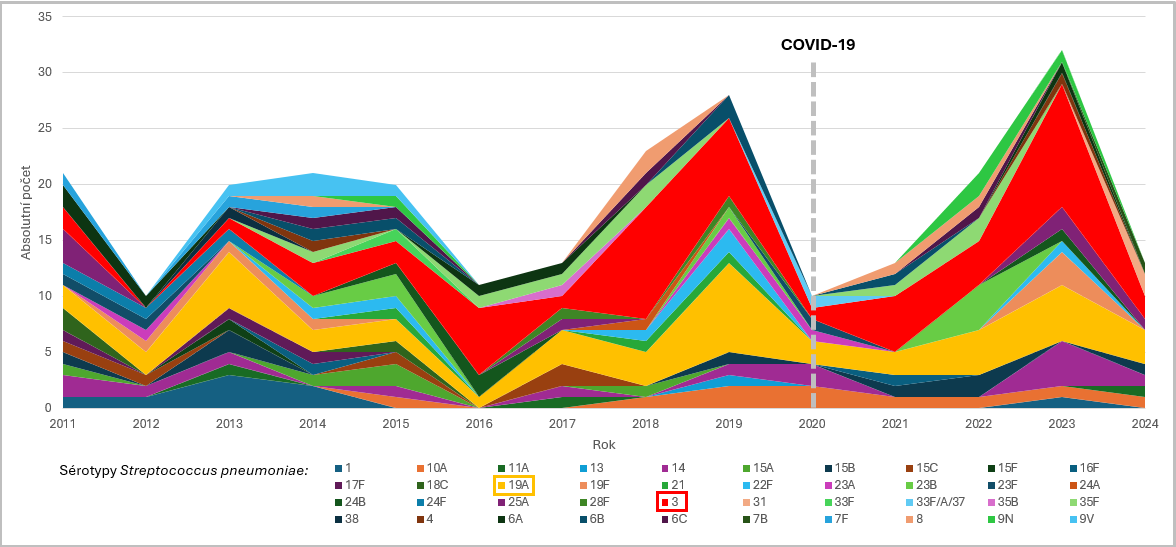
I přes rozšířené užívání konjugovaných pneumokokových vakcín je sérotyp 3 i nadále velkým problémem.16
Prevalence sérotypů způsobujících IPO u dětí ve věku pod 5 let ČR v letech 2011–20242-16
Sérotyp 3 je spojen s:
- Vysokým invazivním potenciálem22
- Komplikovanou pneumonií23
- Rizikem úmrtí23
POMOZTE SVÝM PEDIATRICKÝM PACIENTŮM K SILNÉ IMUNITNÍ ODPOVĚDI PROTI STREPTOCOCCUS PNEUMONIAE S VAXNEUVANCE®
3dávkový režim (2 dávky primární série + 1 posilující dávka)
Vaxneuvance® vyvolala silnou imunitní odpověď pro 13 společných sérotypů s PCV13, včetně sérotypu 31
Vaxneuvance® vs PCV13
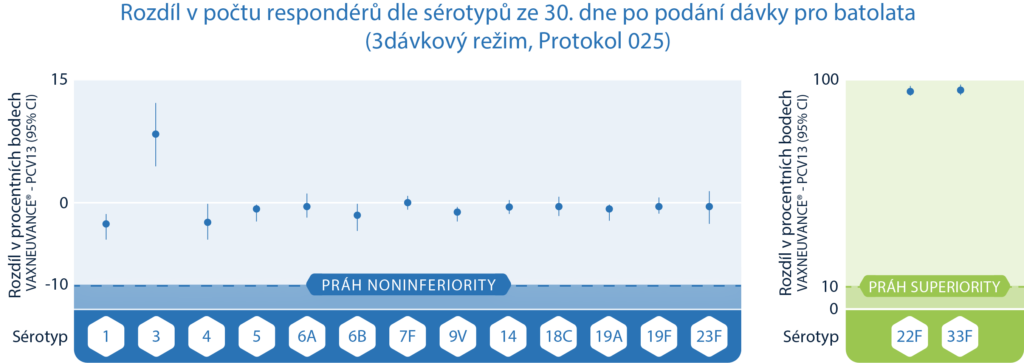
Respondéry byla batolata, která dosáhla prahu ochrany doporučeného Světovou zdravotnickou organizací, definovanou jako sérotypově specifická hodnota IgG protilátek odpovídající ≥0,35 μg/ml.1
Vaxneuvance® rozšiřuje sérotypové pokrytí o důležité sérotypy způsobující invazivní onemocnění a zachovává imunogenitu pro sérotypy nacházející se v předchozích pneumokokových konjugovaných vakcínách:1
- Silná imunitní odpověď pro všech 15 sérotypů, včetně sérotypu 3, který je přední příčinou IPO u dětí do 5 let věku v ČR.1-16
- Noninferiorní imunitní odpověď pro všech 13 sérotypů společných s PCV13
- Superiorní imunitní odpověď pro unikátní sérotypy 22F a 33F, které jsou stále častější příčinou IPO po celém světě1, 17-18
Design studie: 3dávkový režim (2 dávky primární série + 1 dávka pro batolata): V dvojitě zaslepené, aktivním komparátorem kontrolované studii (Protokol 025) bylo randomizováno 1 184 účastníků do skupiny, kterým se ve 3dávkovém režimu podávala vakcína Vaxneuvance® nebo 13valentní pneumokoková konjugovaná vakcína. První dvě dávky byly podány kojencům ve věku 2 až 4 měsíce (primární série) a třetí dávka se podávala dětem ve věku 11 až 15 měsíců (dávka pro batole). Závěr o noninferioritě pro 13 společných sérotypů je založen na spodní hranici 95% CI dosahující > -10 procentních bodů pro rozdíly v mírách odpovědi IgG (Vaxneuvance® – 13valentní pneumokoková vakcína) nebo dosahující > 0,5 pro poměr GMC IgG (Vaxneuvance®/13valentní pneumokoková konjugovaná vakcína). Závěr o superioritě pro 2 unikátní sérotypy 22F a 33F je založen na spodní hranici 95% CI dosahující > 10 procentních bodů pro rozdíly v mírách odpovědí IgG (Vaxneuvance® – 13valentní pneumokoková vakcína) nebo dosahující > 2,0 pro poměr GMC IgG (Vaxneuvance®/13valentní pneumokoková vakcína).1
4dávkový režim (3 dávky primární série + 1 posilující dávka)
Vaxneuvance® vyvolala silnou imunitní odpověď pro 13 společných sérotypů s PCV13, včetně sérotypu 3.1
Vaxneuvance® vs PCV13

Respondéry byly děti, které dosáhly prahu ochrany doporučeného Světovou zdravotnickou organizací, definovanou jako sérotypově specifická hodnota IgG protilátek odpovídající ≥0,35 μg/ml.1
Vakcína Vaxneuvance® vyvolává imunitní odpovědi pro společný sérotyp 3 a pro 2 dodatečné sérotypy, které byly značně vyšší v porovnání s imunitními odpověďmi vykázané 13valentní pneumokokovou konjugovanou vakcínou (hodnoceno mírou odpovědi IgG a pomocí geometrických středních hodnot koncentrací IgG 30 dní po primární sérii).1
Design studie: 4dávkový režim (3 dávky primární série + 1 dávka pro batolata) V pivotní, dvojitě zaslepené, aktivním komparátorem kontrolované studii (Protokol 029) bylo 1720 účastníků randomizováno do skupiny, ve které dostávali buď Vaxneuvance® (N=858) nebo PCV13 (N=856) ve 4dávkovém režimu současně s jinými pediatrickými vakcínami. Primární série byla podávána ve věku 2, 4 a 6 měsíců a dávka pro batolata byla podávána ve 12. až 15. měsíci věku. Noninferiorita byla založena na >-10-bodovém rozdílu v procentech spodní hranice 2-stranné 95% CI pro míru odpovědi IgG pro Vaxneuvance® vs. PCV13 pro 13 sdílených sérotypů.1 Třicet dní po primární sérii jsou sérotypově specifické geometrické střední hodnoty koncentrací IgG noninferiorní vůči 13valentní pneumokokové konjugované vakcíně pro 12 ze 13 společných sérotypů. Odpověď IgG na sérotyp 6A těsně nedosáhla předem specifikovaného kritéria noninferiority. Vakcína Vaxneuvance navíc vyvolává imunitní odpovědi pro společný sérotyp 3 a pro 2 dodatečné sérotypy, které byly značně vyšší v porovnání s imunitními odpověďmi vykázané 13valentní pneumokokovou konjugovanou vakcínou, hodnoceno mírou odpovědi IgG a pomocí geometrických středních hodnot koncentrací IgG.1
VAXNEUVANCE® BYLA HODNOCENA V KLINICKÉM PROGRAMU U TISÍCŮ DĚTÍ
Více než 7 000 kojenců a dětí bylo zařazeno do klinických studií s cílem stanovit bezpečnost, snášenlivost a imunogenitu vakcíny Vaxneuvance®.1

Vaxneuvance® prokázala silné imunitní odpovědi jak u zdravých kojenců a dětí, tak i u dětí se zvýšeným rizikem invazivního pneumokokového onemocnění.1
aMéně než 37 týdnů těhotenství při narození1
bTato studie zahrnuje děti od 6 do 17 let s počtem buněk CD4+T ≥ 200 buněk na mikrolitr a hodnotami plasmy HIV RNA < 50 000 kopií/mL.1
cTato studie zahrnuje děti i dospělé (n=277).1
HIV = virus lidské imunodeficience; RNA = kyselina ribonukleová
Jedincům, kteří mají jedno nebo více základních onemocnění, které/která je predisponuje/predisponují ke zvýšenému riziku pneumokokového onemocnění (jako jsou jedinci se srpkovitou anémií nebo s infekcí virem lidské imunodeficience (HIV) nebo jedinci po transplantaci hematopoetických kmenových buněk (HSCT) nebo imunokompetentní jedinci ve věku 18 až 49 let s rizikovými faktory pro pneumokokové onemocnění; viz SPC), může být podána jedna nebo více dávek vakcíny Vaxneuvance®.1
Klinická imunogenita u zvláštních skupin pacientů
Děti s virem HIV
Ve dvojitě zaslepené popisné studii (Protokol 030) byla vakcína Vaxneuvance® hodnocena u 203 dětí ve věku 6 až méně než 18 let s virem HIV. Z těchto dětí mělo 17 (8,4 %) dětí počty T-lymfocytů CD4+ <500 buněk/μl a hodnotou RNA HIV v plasmě <50 000 kopií/ml. V této studii bylo randomizováno 407 účastníků do skupiny, která dostala jednu dávku buď vakcíny Vaxneuvance® nebo 13valentní pneumokokové konjugované vakcíny, o 2 měsíce později následovala polyvalentní pneumokoková vakcína 23 (PPV 23). Vakcína Vaxneuvance® byla imunogenní při hodnocení pomocí sérotypově specifických geometrických středních hodnot koncentrací IgG a geometrických středních hodnot titrů OPA 30 dní po vakcinaci pro všech 15 sérotypů obsažených ve vakcíně Vaxneuvance®. Sérotypově specifické geometrické střední hodnoty koncentrací IgG a geometrické střední hodnoty titrů OPA byly pro 13 společných sérotypů obecně srovnatelné a vyšší pro 2 dodatečné sérotypy (22F a 33F). Po sekvenčním podání s vakcínou PPV 23 byly 30 dní po vakcinaci pro všech 15 sérotypů obsažených ve vakcíně Vaxneuvance® mezi oběma vakcinačními skupinami geometrické střední hodnoty koncentrací IgG a geometrické střední hodnoty titrů OPA obecně srovnatelné.1
Děti se srpkovitou anémií
Ve dvojitě zaslepené popisné studii (Protokol 023) byla vakcína Vaxneuvance® hodnocena u dětí ve věku 5 až méně než 18 let se srpkovitou anémií. Pacientům randomizovaným do této studie mohla být podána rutinní pneumokoková vakcína během prvních dvou let života, ale nebyla jim podána pneumokoková vakcína během 3 let před vstupem do této studie. Všech 104 účastníků bylo randomizováno v poměru 2:1 do skupiny, která dostala jednu dávku buď vakcíny Vaxneuvance® nebo 13valentní pneumokokové konjugované vakcíny. Vakcína Vaxneuvance® byla imunogenní při hodnocení pomocí sérotypově specifických geometrických středních hodnot koncentrací IgG a geometrických středních hodnot titrů OPA 30 dní po vakcinaci pro všech 15 sérotypů obsažených ve vakcíně Vaxneuvance®. Sérotypově specifické geometrické střední hodnoty koncentrací IgG a geometrické střední hodnoty titrů OPA byly pro 13 společných sérotypů obecně srovnatelné a pro 2 dodatečné sérotypy (22F a 33F) vyšší.1
Děti a dospělí, kterým byly transplantovány hematopoetické kmenové buňky
Ve dvojitě zaslepené, popisné studii (Protokol 022) byla hodnocena vakcína Vaxneuvance® u dospělých a dětí ve věku ≥ 3 let, kteří podstoupili alogenní transplantaci hematopoetických kmenových buněk (allo-HSCT) 3 až 6 měsíců před zařazením. V této studii bylo randomizováno 277 účastníků, kteří dostali 3 dávky buď vakcíny Vaxneuvance® nebo 13valentní pneumokokové konjugované vakcíny s měsíčním odstupem mezi dávkami. Dvanáct měsíců po allo-HSCT obdrželi účastníci bez chronické reakce štěpu proti hostiteli (cGvHD) jednu dávku 23valentní pneumokokové polysacharidové vakcíny a účastníci s chronickou reakcí štěpu proti hostiteli obdrželi čtvrtou dávku buď vakcíny Vaxneuvance® nebo 13valentní pneumokokové konjugované vakcíny. Vakcína Vaxneuvance® byla imunogenní pro všech 15 ve vakcíně obsažených sérotypů u příjemců allo-HSCT, hodnoceno pomocí geometrických středních hodnot koncentrací IgG a geometrických středních hodnot titrů OPA 30 dní po třetí dávce vakcíny Vaxneuvance®. Sérotypově specifické geometrické střední hodnoty koncentrací IgG a geometrické střední hodnoty titrů OPA byly obecně srovnatelné mezi dvěma vakcinačními skupinami pro 13 společných sérotypů a vyšší u vakcíny Vaxneuvance® pro dva dodatečné sérotypy (22F a 33F). Podobně u účastníků, kteří obdrželi po 12 měsících od allo-HSCT buď vakcínu Vaxneuvance® nebo 13valentní pneumokokovou konjugovanou vakcínu, byly 30 dní po vakcinaci geometrické střední hodnoty koncentrací IgG a geometrické střední hodnoty titrů OPA mezi dvěma vakcinačními skupinami obecně srovnatelné pro 13 společných sérotypů a vyšší u vakcíny Vaxneuvance® pro dva dodatečné sérotypy (22F a 33F). U účastníků, kteří obdrželi po 12 měsících od allo-HSCT 23valentní pneumokokovou polysacharidovou vakcínu, byly 30 dní po vakcinaci geometrické střední hodnoty koncentrací IgG a geometrické střední hodnoty titrů OPA mezi dvěma vakcinačními skupinami obecně srovnatelné pro všech 15 sérotypů obsažených ve vakcíně Vaxneuvance®.1
VAXNEUVANCE® PROKÁZALA BEZPEČNOSTNÍ PROFIL SROVNATELNÝ S PCV13
Vakcína Vaxneuvance® byla hodnocena u široké škály pediatrických populací, kde prokázala bezpečnostní profil srovnatelný s PCV13.1
Bezpečnostní profil Vaxneuvance® byl konzistentní napříč klinickými studiemi pro zdravé kojence a děti, i pro děti se zvýšeným rizikem invazivních pneumokokových onemocnění (IPO).1

aMezi osoby se zvýšeným rizikem IPO patří předčasně narození kojenci, děti se srpkovitou anémií a děti s HIV.1
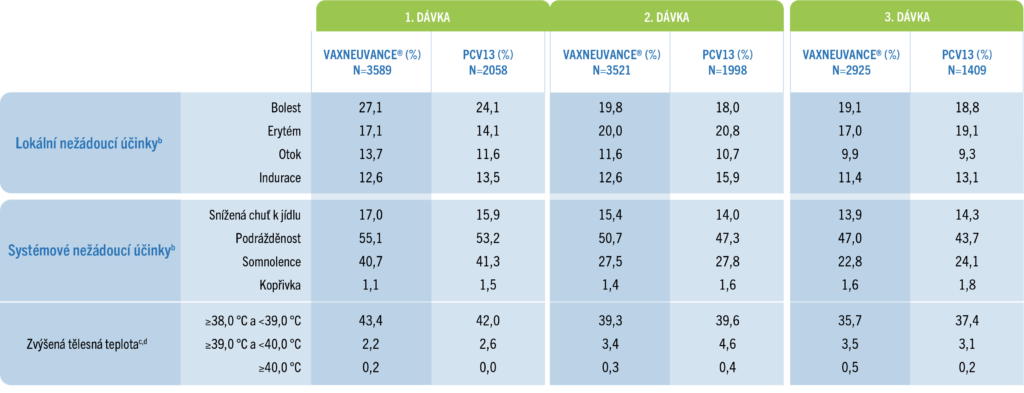
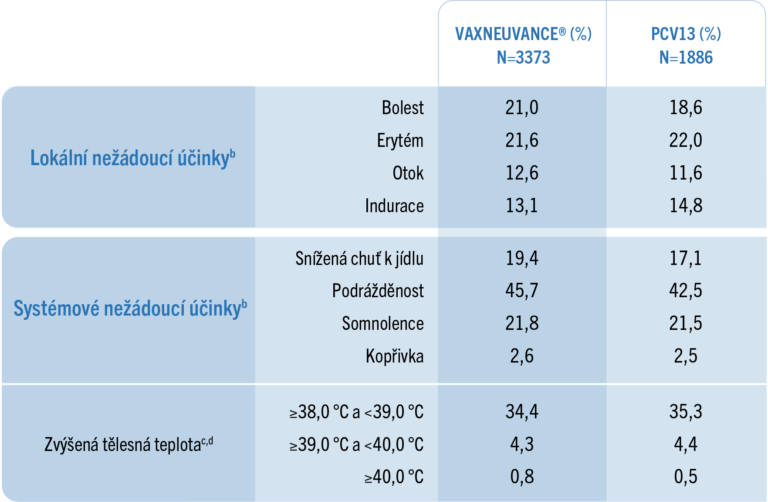
Zjištěné lokální a systémové nežádoucí účinky (15valentní a 13valentní pneumokoková konjugovaná vakcína)
Většina zaznamenaných uvedených nežádoucích účinků byla mírná až středně závažná (na základě intenzity nebo velikosti) a byla krátkého trvání (≤3 dny).1
U zdravých a předčasně narozených kojencůa:
U zdravých batolat:
aDonošení kojenci byli ošetřeni 1. a 2. dávkou v rámci 2dávkové primární série. Předčasně narození kojenci byli ošetřeni 1., 2. a 3. dávkou v rámci 3dávkové primární série.
bZjištěné mezi 1. a 14. dnem po vakcinaci po každé dávce.
cZjištěné mezi 1. a 7. dnem po vakcinaci po každé dávce.
dProcenta odrážejí počet účastníků s údaji o teplotě na základě rektální ekvivalentní teploty.
INTERAKCE S JINÝMI LÉČIVÝMI PŘÍPRAVKY
Kojenci a děti ve věku od 6 týdnů až do < 2 let

Vakcínu Vaxneuvance® lze podávat současně s kterýmkoli z následujících vakcinačních antigenů, buď ve formě monovalentních nebo kombinovaných vakcín: záškrt, tetanus, černý kašel, poliomyelitida (sérotypy 1, 2 a 3), hepatitida A, hepatitida B, Haemophilus influenzae typu b, spalničky, příušnice, zarděnky, plané neštovice a rotavirová vakcína.1
Děti a dospívající ve věku od 2 do < 18 let
Pro podávání vakcíny Vaxneuvance® současně s jinými vakcínami nejsou k dispozici žádné údaje.1
MŮŽETE ZAČÍT OČKOVAT SVÉ PEDIATRICKÉ PACIENTY VAKCÍNOU VAXNEUVANCE® JIŽ DNES
Vaxneuvance® může být podána:1

Vakcinační schéma Vaxneuvance® pro kojence a děti ve věku od 6 týdnů do < 2 let:1
Použití vakcíny Vaxneuvance® má být v souladu s oficiálními doporučeními1


*Podání čtvrté posilovací dávky se doporučuje nejméně 2 měsíce po třetí dávce1
U předčasně narozených kojenců (<37 gestačních týdnů při narození) se doporučený imunizační režim skládá ze 4 dávek. Doporučený imunizační režim se skládá ze třídávkové primární série vakcíny Vaxneuvance®, následované čtvrtou (posilovací) dávkou, každá po 0,5 ml, stejné podání jako pro třídavkovou primární sérii následovanou posilovací dávkou.1
Předchozí vakcinace jinou pneumokokovou konjugovanou vakcínou u kojenců a dětí ve věku 6 týdnů do < 2 let

*Design studie: Ve dvojitě zaslepené, aktivním komparátorem kontrolované popisné studii (Protokol 027) bylo randomizováno 900 účastníků v poměru 1:1:1:1:1 do jedné z pěti vakcinačních skupin, jimž se podával úplný nebo smíšený dávkovací režim pneumokokových konjugovaných vakcín. Ve dvou vakcinačních skupinách dostávali účastníci 4dávkový režim buď vakcíny Vaxneuvance® nebo 13valentní pneumokokové konjugované vakcíny. Ve třech zbývajících vakcinačních skupinách se vakcinační série zahajovaly 13valentní pneumokokovou konjugovanou vakcínou a při 2., 3. nebo 4. dávce se přešlo na vakcínu Vaxneuvance®. Sérotypově specifické geometrické střední hodnoty koncentrací IgG 30 dní po dávce pro batolata byly pro 13 společných sérotypů, hodnoceno pomocí poměrů geometrických středních hodnot koncentrací IgG, obecně srovnatelné u účastníků, jimž se podávaly smíšené režimy vakcíny Vaxneuvance® a 13valentní pneumokokové konjugované vakcíny, a u účastníků, kteří dostali úplný dávkovací režim 13valentní pneumokokové konjugované vakcíny. 1
Doočkovací (catch-up) schéma pro děti ve věku od 7 měsíců až < 18 let:1
U dětí v následujících věkových rozmezích, které pneumokokovou vakcínou dosud očkovány nebyly nebo nebyly očkovány úplně:1
- 7 až 11 měsíců věku: 3 dávky (první 2 dávky je nutno podat s odstupem nejméně 4 týdnů; třetí dávka se podává po dosažení 12 měsíců věku a nejméně 2 měsíce po druhé dávce)
- 12 až 23 měsíců věku: 2 dávky (podané s odstupem 2 měsíců)
- 2 až 17 let věku: 1 dávka
Pokud byla předtím podána pneumokoková vakcína, musí před podáním vakcíny Vaxneuvance® uplynout nejméně 2 měsíce.1
Způsob podání
Vakcínu je nutno aplikovat intramuskulární injekcí. Přednostním místem podání je anterolaterální část stehna u kojenců nebo m. deltoideus v oblasti horní části paže u dětí a dospělých. Ohledně podání subkutánní nebo intradermální cestou nejsou k dispozici žádné údaje.1
REFERENCE
- SPC Vaxneuvance, datum revize textu 16. 11. 2023
- Zprávy CEM (SZÚ, Praha), 2025, 34 (3-4): 116-121.
- Zprávy CEM (SZÚ, Praha), 2024, 33 (6): 193-197.
- Zprávy CEM (SZÚ, Praha). 2023; 32(6-7): 261–266.
- Zprávy CEM (SZÚ, Praha) 2022; 31(6): 217–221.
- Zprávy CEM (SZÚ, Praha) 2021; 30(4): 115–120.
- Zprávy CEM (SZÚ, Praha) 2020; 29 (6): 246–252.
- Zprávy CEM (SZÚ, Praha) 2019; 28(7): 277-282.
- Zprávy CEM (SZÚ, Praha) 2018; 27(2): 49–55.
- Zprávy CEM (SZÚ, Praha) 2017; 26(1): 21–28.
- Zprávy CEM (SZÚ, Praha) 2016; 25(3): 100–107.
- Zprávy CEM (SZÚ, Praha) 2015; 24(3): 96–101.
- Zprávy CEM (SZÚ, Praha) 2014; 23(3): 89–97.
- Zprávy CEM (SZÚ, Praha) 2013; 22(3): 97–104.
- Zprávy CEM (SZÚ, Praha) 2012; 21(2): 51–58.
- European Centre for Disease Prevention and Control. Invasive pneumococcal disease. In: ECDC. Annual epidemiological report for 2018. Stockholm: ECDC. 2020.
- Gierke R, Wodi AP, Kobayashi M. Centers for Disease Control and Prevention. Pneumococcal disease. Reviewed August 18, 2021. Accessed October 20, 2022.
- American Academy of Pediatrics. 10 common childhood illnesses and their treatments. Updated November 21, 2019. Accessed October 20, 2022.
- Centers for Disease Control and Prevention. Symptoms and complications of pneumococcal disease. Reviewed September 1, 2020. Accessed October 20, 2022.
- Danishyar A, Ashurst JV. Acute Otitis Media. NIH. National Library of Medicine. Accessed October 20, 2022.
- European Center for Disease and Prevention Control. Fact sheet about pneumococcal disease. Accessed October 20, 2022.
- del Amo E, Brotons P, Monsonis M, Trivino M, et al. High invasiveness of pneumococcal serotypes included in the new generation of conjugate vaccines. Clin Microbiol Infect. 2014;20(7):684-689.
- Luck JN, Tettelin H, Orihuela CJ. Sugar-coated killer: serotype 3 pneumococcal disease. Front Cell Infect Microbiol. 2020;10:613287.