Horizontální přenos infekce HPV
Lidské papilomaviry (HPV – human papillomavirus) jsou malé, neobalené DNA viry z rodiny Papillomaviridae.1,2 Infekce HPV je celosvětově nejčastější sexuálně přenosnou infekcí1 a její hlavní a nejčastější přenosnou cestou je pohlavní styk – vaginální, orální i anální. Celoživotní pravděpodobnost výskytu infekce HPV u osob s alespoň jedním sexuálním partnerem opačného pohlaví dosahuje průměrně 85 % u žen a 91 % u mužů, přičemž do věku 45 let se s virem HPV setká více než 80 % žen i mužů.3 Přestože je sexuální přenos dominantní, HPV infekce se může přenášet i nepohlavní cestou, a to vertikálně, tedy z rodičů (nejčastěji matky) na dítě (na úrovni embrya při fertilizaci, in utero, a zejména při porodu), nebo horizontálně, u sexuálně neaktivních dospělých a dětí.4
Horizontální přenos HPV
K horizontální transmisi infekce HPV může docházet prostřednictvím autoinokulace (zavlečení viru z infikované oblasti kůže/sliznice do oblasti zdravé kůže/sliznice u téhož jedince), heteroinokulace (přenos viru z infikované oblasti kůže/sliznice do oblasti zdravé kůže/sliznice u jiného jedince) či fomitů (viz dále).4
Další možností je přenos HPV cestou fomitů (fomity jsou neživé předměty, které mohou být kontaminovány patogenními mikroorganismy, a sloužit tak jako zdroj infekce).4,8-10 Je známo, že HPV jsou velmi odolné viry (viz níže). K jejich odolnosti přispívá také to, že jsou odlučovány spolu s keratinocyty, které mohou působit jako sekundární struktura chránící virovou kapsidu (síť keratinu, neporušená buněčná membrána) před vlivy prostředí, což viru umožňuje déle přežít.10 HPV odolávají vysokým teplotám i vyschnutí (po 7 dnech dehydratace stále vykazovaly 30% infekčnost11) a jsou odolné rovněž vůči mnoha běžně používaným dezinfekčním prostředkům. Ve studii testující citlivost rekombinantních virionů HPV-16 vůči 11 dezinfekčním činidlům bylo zjištěno, že virus si zachovává citlivost pouze vůči chlornanu a dezinfekčnímu prostředku na bázi kyseliny peroctové a stříbra.12 Studie naopak prokázala rezistenci viru vůči glutaraldehydu (který se používá jako širokospektré antimikrobiální činidlo a je účinný vůči mnoha mikrobiálním patogenům, včetně neobalených virů, konkrétně adenovirů, parvovirů, kalcivirů a mnohých enterovirů10) i jeho nové alternativě ortoftaladehydu, a stejně jako většina neobalených virů byl HPV rezistentní vůči dezinfekci na bázi alkoholu, včetně etanolu a izopropanolu.12 Tato rezistence HPV vůči alkoholovým dezinfekčním prostředkům dokládá, že systémy dezinfekce rukou, na které se často spoléhá, nejsou dostačující k účinné kontrole šíření HPV.10 Také vysoušecí vlastnosti alkoholů mohou působit ve prospěch viru, neboť bylo prokázáno, že poté, co kontaminant na povrchu zaschne, působí dezinfekční prostředky méně účinně. Vysoká stabilita HPV a jeho schopnost odolávat běžným dezinfekčním prostředkům je důkazem, že tento virus se může přenášet prostřednictvím inokulovaných povrchů a fomitů.10
Potenciálně významný je rovněž přenos HPV prostřednictvím zdravotnických (gynekologických) nástrojů, jako jsou například transvaginální ultrazvukové sondy. Při jejich použití dochází k těsnému kontaktu sondy s děložním čípkem nebo stěnou pochvy, což představuje potenciální cestu pro infekci HPV. Sondy jsou dezinfikovány jemnými dezinfekčními prostředky, aby nedošlo k jejich poškození, a při jejich použití se na sondy navléká kondom (případně jiný ochranný kryt), který působí jako fyzická bariéra proti kontaminaci, nicméně s určitým rizikem ruptury (v klinické studii hodnotící integritu krytů ultrazvukových sond používaných k transvaginálnímu vyšetření se frekvence ruptur u kondomů pohybovala v širokém rozmezí 0,4–13 % a u komerčních krytů v rozmezí 0–5 %; nejnižší míru poškození vykazovaly komerční nelatexové kryty, nejvyšší míru poškození naopak nelatexové kondomy13). Studie posuzující riziko kontaminace endovaginálních ultrazvukových sond, ve které bylo vyšetřeno 217 vzorků odebraných ze sond před vyšetřením a 200 vzorků odebraných po vyšetření, prokázala pozitivitu DNA vysoce rizikových HPV (konkrétně HPV-16, 31, 2×53 a 58) ve 3,0 % vzorků po vyšetření. HPV DNA byla přítomna rovněž ve 2,7 % vzorků před vyšetřením, přičemž v 1,9 % vzorků byla zjištěna přítomnost DNA vysoce rizikových HR HPV (HPV-53 a 70). Ukázalo se tak, že v některých případech dochází ke kontaminaci endovaginálních ultrazvukových sond, a to navzdory jejich zakrytí a dezinfekci přípravky s obsahem kvartérních amoniových sloučenin. Autoři vyvozují, že endovaginální ultrazvukové sondy je nutné považovat za potenciální zdroj nosokomiálních infekcí HR HPV.14
K obdobným závěrům dospěly také další studie. Ve studii provedené na pohotovostním oddělení byla HPV DNA (při použití krytu a dezinfekce) nalezena celkově v 7,5 % (n = 120), stěrů z transvaginálních ultrazvukových sond, po vyšetření žen s prokázanou infekcí HPV (n = 14), pak byla detekována ve 21 % stěrů.15 Další studie ukázala, že transvaginální ultrazvukové sondy mohou být kontaminovány nejen HPV DNA, ale i volnými viriony (to bylo zjištěno na základě ošetření vzorků stěrů exonukleázou, která zničí veškerou nechráněnou DNA; HPV DNA, která je chráněna uvnitř kapsidy, není zničena a lze ji detekovat po uvolnění z kapsidy).10,16 Kromě ultrazvukových sond mohou být kontaminovány také jiné předměty. To prokázala studie, která analyzovala 179 vzorků z fomitů (box na rukavice, lampa gynekologického křesla, tuby s gelem pro ultrazvukové vyšetření, kolposkop, zrcadla) ve dvou fakultních nemocnicích a ve čtyřech soukromých gynekologických ordinacích. Pozitivita HPV DNA byla zjištěna v 18 % vzorků, přičemž při porovnání center bylo zjištěno vyšší riziko kontaminace HPV v soukromých gynekologických ordinacích ve srovnání s nemocnicemi (OR: 2,69; 95% CI: 1,06–6,86). Nejvyšší riziko kontaminace pak bylo shledáno u kolposkopu (OR: 3,02; 95% CI: 0,86–10,57).17
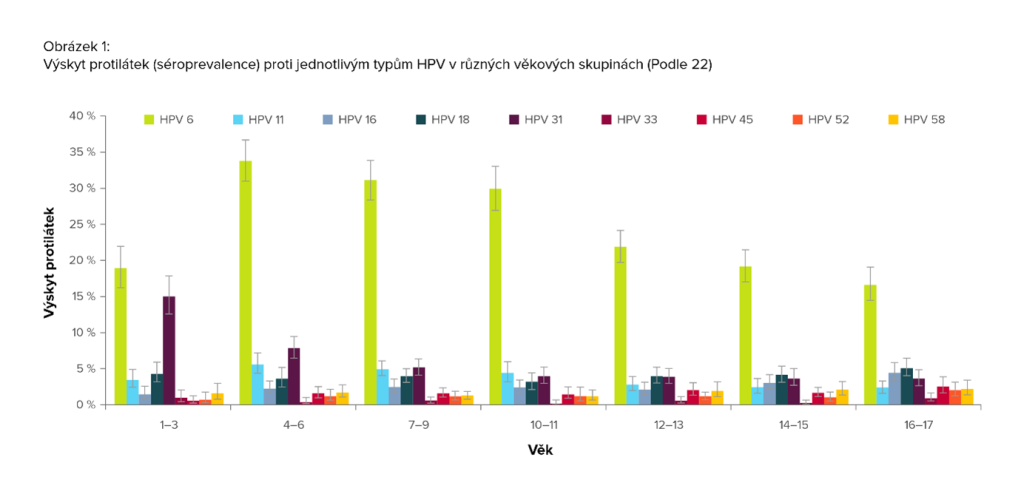
Studie séroprevalence HPV u dětí
Co se týká studií séroprevalence (tedy tvorby protilátek odrážející setkání s HPV) u dětí, lze zmínit výsledky poměrně rozsáhlé německé studie provedené u dětí ve věku 1–17 let (n = 12 257, podíl chlapců: 51,3 %, podíl dívek: 48,7 %) v letech 2003–2005, tedy před zavedením vakcinace proti HPV. Séroprevalence pro všechny slizniční typy kromě HPV-6 se pohybovala v rozmezí 0,6 % (protilátky proti HPV-33) do 6,4 % (protilátky proti HPV-31). HPV-6 se od ostatních slizničních HPV lišil vysokou celkovou séroprevalencí (24,8 %), přičemž nejvyšší hodnota (33,8 %) byla pozorována ve věkové skupině 4–6 let, nejnižší naopak ve věkové skupině 16–17 let (16,6 %) (obrázek 1). U dívek byla séroprevalence pro HPV-6 mírně nižší (23,1 %) než u chlapců (26,4 %), séroprevalence pro všechny ostatní slizniční typy HPV byla u obou pohlaví srovnatelná. Séroprevalence pro HPV-11 byla podobná jako u HPV-6 (pokud jde o věkovou distribuci), s nejvyšší séroprevalencí ve věkové skupině 4–6 let.18
Co se týká HR HPV, séroprevalence pro HPV-16 byla 2,6 %; v nejmladších věkových skupinách zůstávala relativně stabilní s 1,5 % u 1–3letých a 2,1 % u 12–13letých, poté se zvýšila na 3,1 % u 14–15letých a 4,4 % u 16-17letých. Séroprevalence pro HPV-18 byla v jednotlivých věkových skupinách velmi podobná, nejvyšší byla v nejstarší věkové skupině (5,1 %). Séroprevalence pro HPV-33, 45, 52 a 58 byla obecně nízká, mírně vyšší byla ve starších věkových skupinách. Séroprevalence pro HPV-31 byla nejvyšší (15,1 %) v nejmladší věkové skupině a s věkem klesala (obrázek 1). Ve studii tedy byla zaznamenána významná séroprevalence pro slizniční HPV u dětí, které byly starší, než aby měly mateřské protilátky (získané vertikálně), a mladší, než aby získaly protilátky proti HPV prostřednictvím sexuálního kontaktu.18
V České průřezové studii z roku 2012 byly protilátky proti vakcinačním typům HPV zjištěny u 18,0 % dětí ve věku 6–14 let vs. u 26,4 % osob starších 14 let. Podrobná analýza séropozitivity odhalila u 11-, 12- a 13letých dívek výrazný nárůst protilátek proti HPV-6 či 11 z 6,1 % na 16,7 % a 25,9 % a protilátek proti HPV-16 či 18 z 0,0 % na 6,7 % a 14,8 %. Ve stejných věkových kohortách chlapců vykazovalo séropozitivitu pro HPV-6 či 11 13,3 %, resp. 17,1 %, resp. 21,3 %, zatímco prevalence protilátek proti HPV-16 či 18 byla nízká, bez jednoznačného trendu. U dětí ve věku 6–9 let byla přítomnost protilátek proti HPV zjištěna v 16,5 % případů, přičemž většinou byla pozorována séropozitivita pro HPV-6 a/nebo 11 (13,9 %). 3,3 % dětí ve věku 6–9let mělo protilátky proti HR HPV.19 I tyto výsledky potvrzují, že infekce HPV může být získána horizontálně.
Implikace pro očkování proti HPV
K prevenci proti některým benigním i maligním onemocněním souvisejícím s HPV je k dispozici 9valentní vakcína proti HPV-6, 11, 16, 18, 31, 33, 45, 52 a 58 (Gardasil 9), která je plně hrazena ze zdravotního pojištění všem dívkám i chlapcům ve věku od dovršení 11 do dovršení 15 let, lze ji však aplikovat již od věku 9 let.20 Očkování proti HPV je nejúčinnější, je-li podáno před zahájením sexuálního života,21 resp. před prvním kontaktem s HPV. K přenosu HPV nicméně může dojít i dříve, jinou než pohlavní cestou (viz výše). Kromě toho bylo zjištěno, že časnější zahájení očkování zvyšuje pravděpodobnost dokončení vakcinačního schématu (v americké studii byla šance na dokončení kompletní vakcinace proti HPV do 13 let věku očkované osoby 3,5x vyšší u dětí, které zahájily vakcinaci v 9–10 letech, v porovnání s dětmi, které vakcinaci zahájily v 11–12 letech věku).22 Některé evropské země tak přistoupily k očkování v nižším věku, a to již od 9 let (Rakousko, Německo, Lucembursko) či od 10 let (Portugalsko, Švédsko).23 Také v Austrálii se doporučuje očkování (9valentní) vakcínou proti HPV dětem, dospívajícím a mladým dospělým od 9 let věku, přičemž vakcína je hrazena pro osoby od 9 do 25 let věku.25 Zahájení vakcinace proti HPV ve věku 9 let doporučují rovněž americké odborné společnosti a organizace jako American Cancer Society, American Academy of Pediatrics či National HPV Vaccination Roundtable. V pokynech CDC (Centers for Disease Control) a ACIP (Advisory Committee on Immunization Practices) je doporučeno rutinní očkování proti HPV ve věku 11 nebo 12 let, nicméně je zde upozorněno, že vakcína proti HPV může být podána již od 9 let. Zahájení očkování proti HPV ve věku 9 let skýtá mnoho výhod: nabízí více času na dokončení očkovacího schématu do 13 let věku, zvyšuje pravděpodobnost očkování před první expozicí HPV, jeho výsledkem je silná imunitní odpověď na vakcínu proti HPV, je výrazně méně provázeno otázkami týkajícími se sexuální aktivity, vede ke zvýšení míry proočkovanosti, a tím i počtu případů některých nádorových onemocnění spojených se specifickými typy HPV, jejichž vzniku se může pomoci zabránit.24
Závěr
HPV je významným virovým patogenem, který může způsobovat benigní, premaligní i maligní onemocnění u žen i mužů. HPV jsou velmi stabilní viry, které jsou schopny přežívat v prostředí, jsou odolné proti vyschnutí a proti mnoha běžně používaným dezinfekčním prostředkům. Vzhledem k tomu se HPV mohou přenášet nejen sexuální cestou a vertikálně, ale i horizontálně – autoinokulací, heteroinokulací či prostřednictvím fomitů. To podporují i studie prokazující přítomnost HPV DNA či protilátek proti HPV u dětí či osob bez předchozí sexuální zkušenosti. K prevenci proti některým onemocněním souvisejícím s určitými typy HPV je v ČR k dispozici 9valentní vakcína proti HPV, která je indikována k aktivní imunizaci jedinců ve věku od 9 let proti následujícím HPV onemocněním: genitální bradavice, premaligní léze a cervikální, vulvální, vaginální a anální karcinomy způsobené HPV typy obsaženými ve vakcíně; hrazena z veřejného zdravotního pojištění je dívkám i chlapcům od dovršení 11. do dovršení 15. roku věku. V některých státech včetně několika západních zemí se proti HPV očkuje skutečně již od 9 let, neboť časnější zahájení očkování má mnoho výhod.
Literatura
1 Fernandes Q, Allouch S, Gupta I, et al. Human papillomaviruses-related cancers: an update on the presence and prevention strategies in the Middle East and North African regions. Pathogens 2022;11:1380.
2 Tommasino M. The biology of beta human papillomaviruses. Virus Res 2017;231:128–38.
3 Chesson HW, Dunne EF, Hariri S, et al. The estimated lifetime probability of acquiring human papillomavirus in the United States. Sex Transm Dis 2014;41:660–4.
4 Sabeena S, Bhat P, Kamath V, et al. Possible non-sexual modes of transmission of human papilloma virus. J Obstet Gynaecol Res 2017;43:429–35.
5 Winer RL, Hughes JP, Feng Q, et al. Detection of genital HPV types in fingertip samples from newly sexually active female university students. Cancer Epidemiol Biomarkers Prev 2010;19:1682–5. REF-134244
6 Houlihan CF, Baisley K, Bravo IG, et al. Human papillomavirus DNA detected in fingertip, oral and bathroom samples from unvaccinated adolescent girls in Tanzania. Sex Transm Infect 2019;95:374–9.
7 Fu TC, Hughes JP, Feng Q, et al. Epidemiology of human papillomavirus detected in the oral cavity and fingernails of mid-adult women. Sex Transm Dis 2015;42:677–85.
8 Petca A, Borislavschi A, Zvanca ME, et al. Non-sexual HPV transmission and role of vaccination for a better future (Review). Exp Ther Med 2020;20:186.
9 Castaño N, Cordts SC, Kurosu Jalil M, et al. Fomite transmission, physicochemical origin of virus-surface interactions, and disinfection strategies for enveloped viruses with applications to SARS-CoV-2. ACS Omega 2021;6:6509–27.
10 Ryndock EJ, Meyers C. A risk for non-sexual transmission of human papillomavirus? Expert Rev Anti Infect Ther 2014;12:1165–70.
11 Roden RB, Lowy DR, Schiller JT. Papillomavirus is resistant to desiccation. J Infect Dis 1997;176:1076–9.
12 Meyers J, Ryndock E, Conway MJ, et al. Susceptibility of high-risk human papillomavirus type 16 to clinical disinfectants. J Antimicrob Chemother 2014;69:1546–50.
13 Basseal JM, Westerway SC, Hyett JA. Analysis of the integrity of ultrasound probe covers used for transvaginal examinations. Infect Dis Health 2020;25:77–81.
14 Casalegno JS, Le Bail Carval K, Eibach D, et al. High risk HPV contamination of endocavity vaginal ultrasound probes: an underestimated route of nosocomial infection? PLoS One 2012;7:e48137.
15 Ma ST, Yeung AC, Chan PK, et al. Transvaginal ultrasound probe contamination by the human papillomavirus in the emergency department. Emerg Med J 2013;30:472–5.
16 M’Zali F, Bounizra C, Leroy S, et al. Persistence of microbial contamination on transvaginal ultrasound probes despite low-level disinfection procedure. PLoS One 2014;9:e93368.
17 Gallay C, Miranda E, Schaefer S, et al. Human papillomavirus (HPV) contamination of gynaecological equipment. Sex Transm Infect 2016;92:19–23.
18 Loenenbach A, Pawlita M, Waterboer T, et al. Seroprevalence of mucosal and cutaneous human papillomavirus (HPV) types among children and adolescents in the general population in Germany. BMC Infect Dis 2022;22:44.
19 Hamsikova E, Ludvikova V, Stasikova J, et al. Cross-sectional study on the prevalence of HPV antibodies in the general population of the Czech Republic. Sex Transm Infect 2013;89:133–7.
20 Gardasil – Souhrn údajů o přípravku, 10/2024.
21 Boakye AE, McKinney SL, Whittington KD, et al. Association between sexual activity and human papillomavirus (HPV) vaccine initiation and completion among college students. Vaccines (Basel) 2022;10:2079.
22 Saxena K, Kathe N, Sardana P, et al. HPV vaccine initiation at 9 or 10 years of age and better series completion by age 13 among privately and publicly insured children in the US. Hum Vaccin Immunother 2023;19:2161253
23 Colzani E, Johansen K, Johnson H, et al. Human papillomavirus vaccination in the European Union/European Economic Area and globally: a moral dilemma. Euro Surveill 2021;26:2001659.
24 National HPV Vaccination Roundtable- Why Age 9? Fact sheet. Dostupné z: https://hpvroundtable.org/wp-content/uploads/2023/05/HPV_Roundtable-HPV_Why_Age_9_Sales_Sheet_WEB.pdf
25 Australian Immunisation Handbook. Adolescents and young adults are recommended to receive 9vHPV vaccine from 9 years of age. Dostupné z: https://immunisationhandbook.health.gov.au/recommendations/adolescents-aged-9-18-years-are-recommended-to-receive-9vhpv-vaccine
26 Phillips A, Patel C, Pillsbury A, et al. Safety of human papillomavirus vaccines. An updated review. Drug Saf 2018;41:329–46.