Gardasil®9 (dávkování pro osoby ve věku 9-14 let)
Gardasil®9 je rekombinantní, adsorbovaná, 9valentní vakcína proti lidskému papilomaviru (HPV).
Gardasil®9 je indikován k aktivní imunizaci osob od 9 let věku proti následujícím HPV onemocněním:1
- premaligní léze a malignity postihující cervix, vulvu, vaginu a anus způsobené vakcinačními typy HPV
- genitální bradavice (Condyloma acuminata) způsobené specifickými typy HPV
Úhrada
Od 1. 1. 2024 je vakcína Gardasil®9 plně hrazena z prostředků veřejného zdravotního pojištění všem dívkám a chlapcům od 11 let do 14 let včetně.
Gardasil®9 kombinuje1-3
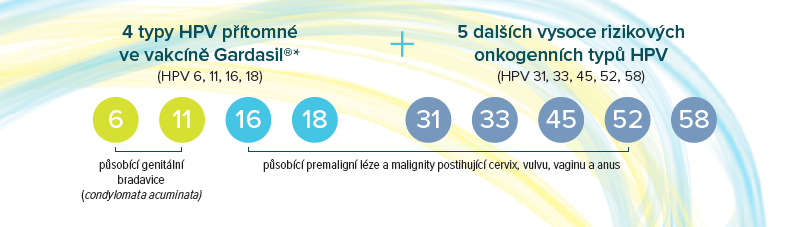
*Vakcína Gardasil® přestala být uváděna na CZ trh k 31. 5. 2023.
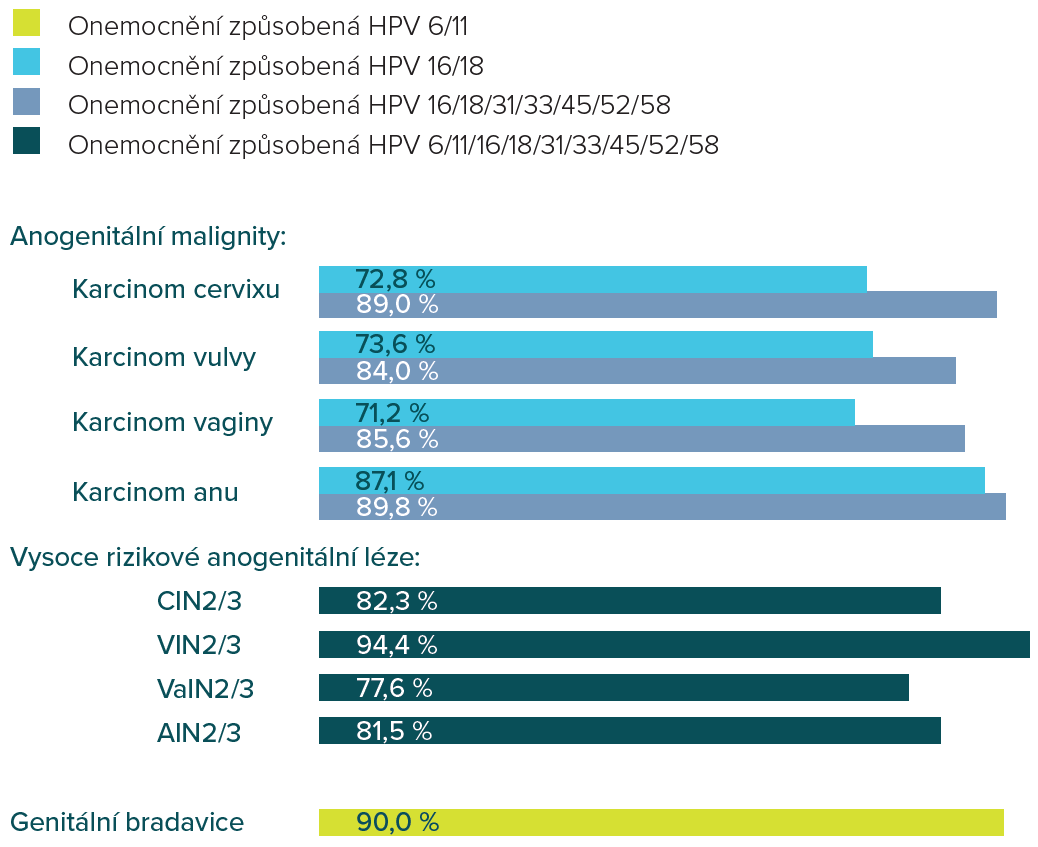
Podíl jednotlivých typů HPV na vzniku onemocnění asociovaných s HPV 2,4
Gardasil®9 v klinických studiích
V klinických studiích v PPE populaci (léčené podle protokolu; Per Protocol Efficacy) byla studováná dlouhodobá účinnost qHPV vakcíny proti cílovým parametrům onemocnění spojených s HPV typu 6, 11, 16 a 18. Byly podány všechny 3 dávky qHPV vakcíny. V dlouhodobých prodlouženích klinických studiích nebyly pozorovány žádné případy intraepiteliálních neoplazií vysokého stupně a genitálních bradavic po dobu sledování až 10,7 roku u dívek (n = 369) a 10,6 roku u chlapců (n = 326), jimž bylo v době očkování 9 až 15 let (medián doby následného sledování byl 10,0 roku u dívek a 9,9 roku chlapců).
V klinické studii byla měřena imunitní odpověď na Gardasil 9 v 7. měsíci jako procento jedinců, kteří byli séropozitivní na protilátky proti příslušným typům HPV obsaženým ve vakcíně 99,2 % až 100 % jedinců ve všech testovaných skupinách bylo séropozitivních na všechny sledované HPV typy 6, 11, 16, 18, 31, 33, 45,52 a 58.
V dlouhodobých prodlouženích klinických studií podle Protokolů 001 a 002 byla pozorována perzistence protilátkové odpovědi po dobu alespoň 10 let u chlapců a dívek ve věku 9 až 15 let v době očkování přípravkem Gardasil 9, v závislosti na typu HPV bylo 81 % až 98 % subjektů séropozitivních.
Bezpečnostní profil vakcíny Gardasil®9
9valentní vakcína proti HPV (Gardasil®9) a 4valentní vakcína proti HPV (Gardasil®) vykazovaly podobný bezpečnostní profil, ačkoliv výskyt reakcí v místě injekce byl numericky vyšší u osob, kterým byl aplikován Gardasil®9.5,8
Nejčastějšími nežádoucími účinky pozorovanými po aplikaci přípravku Gardasil 9 byly reakce v místě aplikace injekce (84,8 % očkovaných jedinců v průběhu 5 dnů po některé z očkovacích návštěv) a bolest hlavy (13,2 % očkovaných jedinců v průběhu 15 dnů následujících po některé z očkovacích návštěv). Tyto nežádoucí účinky byly obvykle mírné nebo středně závažné.
Z reakcí v místě vpichu se nejčastěji vyskytovaly bolest, otok, erytém, pruritus a tvorba modřin, většina z těchto reakcí přitom byla pouze mírné nebo střední intenzity.1,6
Očkovací schéma pro osoby ve věku 9 – 14 let1
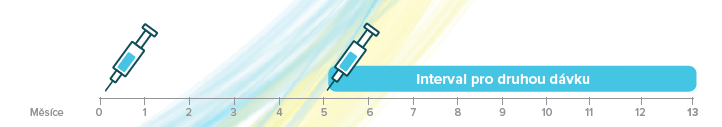
Přípravek Gardasil®9 lze podat podle dvoudávkového schématu. Druhá dávka se má podat za 5 až 13 měsíců po první dávce. Pokud je druhá dávka podána dříve než za 5 měsíců po první dávce, vždy se má podat třetí dávka.
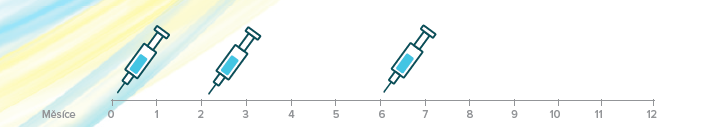
Přípravek Gardasil®9 lze podat podle třídávkového schématu (0, 2, 6 měsíců). Druhá dávka se má podat nejdříve za 1 měsíc po první dávce, třetí dávka se má podat nejdříve za 3 měsíce po druhé dávce. Všechny tři dávky mají být podány v průběhu 1 roku.
Reference:
1. Gardasil 9 – Souhrn údajů o přípravku, datum poslední revize textu: 9/10/2024
2. Hartwig S, et al. Estimation of the overall burden of cancers, precancerous lesions, and genital warts attributable to 9-valent HPV vaccine types in
women and men in Europe. Infect Agent Cancer 2017;12:19.
3. Gardasil – Souhrn údajů o přípravku, datum poslední revize textu: 09/10/2024
4. Hartwig S, et al. Estimation of the epidemiological burden of HPV-related anogenital cancers, precancerous lesions, and genital warts in women and men in Europe: Potential additional benefit of a nine-valent second generation HPV vaccine compared to first generation HPV vaccines. Papillomavirus Res 2015;1:90–100.
5. Joura EA, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med 2015;72(8):71123.
6. Castellsagué X, et al. Immunogenicity and safety of the 9-valent HPV vaccine in men. Vaccine 2015;33(48):6892-901.
7. Joura EA, et al. Immunogenicity and safety of a nine-valent human papillomavirus vaccine in women 27-45 years of age compared to women 16-26 years of age: An open-label phase 3 study. Vaccine 2021;39(20):2800-809.
8. Vesikari T et al. A randomized, double-blind, phase III studyof the immunogenicity and safety of a 9-valent human papillomavirus L1 virus-like particle vaccine (V503) versus GARDASIL® in 9-15-year-old girls. Pediatr Infect Dis J 2015;34:992–8.